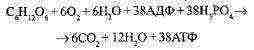A MIKROORGANIZMUSOK MŰVELÉSÉNEK MÓDSZEREI. KULTÚRAI ÉS BIOKÉMIAI TANULMÁNY
TULAJDONSÁGOK
A tenyésztést, vagyis a mikroorganizmusok laboratóriumi tenyésztését használják tulajdonságaik tanulmányozására és biomassza megszerzésére. Táptalajokon baktériumokat, gombákat, aktinomicetákat, spirochetákat és néhány protozoát tenyésztenek. A chlamydia, a rickettsia, a vírusok és egyes protozoonok csak az állat testében vagy élő sejtekben szaporodhatnak.
Az ilyen típusú mikroorganizmusok kulturális tulajdonságai a következők: 1) a szaporodáshoz szükséges feltételek és 2) a táptalajokon történő növekedés jellege. A kulturális tulajdonságok egyike azoknak a jellemzőknek, amelyeket figyelembe vesznek a mikroorganizmusok azonosításakor (típusának meghatározásakor).
Kulturális média
A táptalajoknak meg kell felelniük bizonyos követelményeknek. Tartalmazniuk kell az ilyen típusú mikrobák reprodukciójához szükséges összes tápanyagot. Egyes kórokozó mikroorganizmusok egyszerű táptalajokon nőnek, míg másoknak vérre, vérszérumra és vitaminokra van szükségük a szaporodásukhoz.
A tenyésztőközegben bizonyos körülményeket nátrium -klorid vagy pufferoldatok hozzáadásával kell megteremteni. A legtöbb baktérium számára előnyös a 0,5% nátrium -kloridot tartalmazó tápközeg. A legtöbb patogén baktérium számára kedvező tápközeg reakciója enyhén lúgos, ami a pH = 7,2-7,4 értéknek felel meg. A Vibrio cholerae pH = 7,8-8,5, a gombák-pH = 5-5,5-nél nő. A táptalajnak nedvesnek kell lennie, azaz elegendő mennyiségű vizet kell tartalmaznia, a lehető legátlátszóbbnak és sterilnek kell lennie, azaz vetés előtt nem tartalmazhat mikrobákat.
Összetételét és eredetét tekintve a tápközeg természetes, mesterséges és szintetikus. A természetes táptalajok természetes termékek, például burgonya és más zöldségek. A mesterséges táptalajokat egy speciális recept szerint állítják elő termékekből, szerves és szervetlen vegyületek hozzáadásával. A szintetikus közegek bizonyos kémiai vegyületeket tartalmaznak ismert koncentrációban.
Konzisztenciájuk szerint a táptalajok folyékonyak, félig folyékonyak, sűrűek. Tömítőanyagként általában tengeri moszatból izolált agar-agar-poliszacharidot használnak. Az agar-agart a mikroorganizmusok nem használják tápanyagként; vízben gélt képez, amely 100 ° C-on olvad és 45 ° C-on megszilárdul.
A sűrű tápközeg megszerzése érdekében agar-agart adunk hozzá 1,5-2%koncentrációban, félig folyékony esetén-0,5%.
Rendeltetésüknek megfelelően a tenyésztőközegeket szokásos (egyszerű), speciális, választható, differenciáldiagnosztikára lehet osztani.
Hagyományos (egyszerű) táptalajokat használnak a legtöbb mikroorganizmus termesztésére, ez a mezopátiám húsleves (MPB), a mezopátiás agar (MPA).
Speciális táptalajokat használnak olyan mikroorganizmusok tenyésztésére, amelyek nem egyszerű táptalajon nőnek. Például vér agar és cukor húsleves streptococcus, szérum agar meningococcus és gonococcus esetén.
Az elektív tenyésztő táptalajokat egy faj elkülönítésére használják különböző baktériumok keverékéből. Ez a fajta baktérium gyorsabban és jobban növekszik ezen a környezeten, mint mások, növekedésükben felülmúlva őket; ezen a táptalajon más baktériumok növekedése késik. Például alvadt szérum diftéria bacillus, lúgos pepton víz kolera vibrio, epe húsleves tífusz bacillus, sós közeg staphylococcus ellen.
Differenciáldiagnosztikai táptalajokat használnak bizonyos típusú baktériumok megkülönböztetésére másaktól enzimatikus aktivitásuk alapján (lásd a megfelelő részt).
Az aerob baktériumok tiszta tenyészetének tenyésztése és izolálása
A mikroorganizmusok tenyésztéséhez bizonyos feltételek szükségesek: hőmérséklet, aerob vagy anaerob körülmények.
A hőmérsékletnek optimálisnak kell lennie a faj számára. A legtöbb patogén baktérium 37 ° C -on szaporodik. Egyes fajok esetében azonban az alacsonyabb hőmérséklet az optimális, ami összefüggésben áll ökológiájuk sajátosságaival. Tehát a pestisbacillus esetében, amelynek természetes élőhelye rágcsálók a hibernáció során, az optimális hőmérséklet 28 ° C, mint a leptospiránál, a botulizmus bacillus esetében - 28 ° C -35 ° C.
Az optimális hőmérséklet mellett a mikroorganizmusok tenyésztéséhez a fajtól függően aerob vagy anaerob környezetre van szükség.
A mikrobák morfológiájának, kulturális, biokémiai és egyéb tulajdonságainak tanulmányozása érdekében tiszta tenyészetet kell szerezni. Általában a mikrobák tenyészetét nevezik azoknak a táptalajra történő felhalmozódásának zavarosság, aljközeli (fal) növekedés vagy film formájában a folyékony közeg felületén vagy telepeken sűrű táptalajon. Egyetlen telep képződik egy mikrobiális sejtből. A tiszta tenyészet ugyanazon faj mikrobáinak tenyésztése, amely egyetlen kolóniából származik. A laboratóriumokban bizonyos ismert mikrobatörzseket használnak különböző vizsgálatokhoz. A törzs egy specifikus forrásból, meghatározott időben, ismert tulajdonságokkal rendelkező tiszta mikroorganizmus -tenyészet. A mikrobiális törzseket jellemzően meghatározott számmal jelölik. Például a Staphylococcus aureus 209P törzset használják a penicillin aktivitásának meghatározására.
A tiszta aerob tenyészetek izolálása általában három napig tart, és a következő séma szerint történik:
1. nap - a vizsgálati anyagból származó kenet mikroszkópiája, festve (általában Grammal) - a mikroflóra előzetes megismeréséhez, amely hasznos lehet az oltáshoz használt táptalaj kiválasztásában. Ezután az anyagot beoltjuk a fagyasztott tápanyag agar felületére, hogy izolált telepeket kapjunk. A szitálás a Drygalsky módszer szerint elvégezhető három Petri -csészébe tápközeggel. Egy csepp anyagot viszünk fel az első csészére, és spatulával eloszlatjuk az egész csészén. Ezután ugyanazzal a spatulával oszlassa el rajta a fennmaradó tenyészetet a második csészén, és ugyanígy a harmadik csészén. A legtöbb kolónia az első lemezen nő, a legkevesebb a harmadikon. Az egyik lemezen elszigetelt telepek nőnek, attól függően, hogy hány mikrobiális sejt volt a vizsgálati anyagban.
Ugyanezt az eredményt lehet elérni egy csésze szitálásával. Ehhez ossza a csészét négy szektorra. A vizsgált anyagot bakteriológiai hurokkal oltjuk be az első szektoron, majd a kalcinálás és lehűtés után az oltást elosztjuk az első szektorból a másodikba, és ugyanígy szekvenciálisan a harmadik és negyedik szektorba. Az izolált telepeket az egyes mikrobiális sejtekből termosztátban történő napi inkubálás után alakítják ki.
2. nap - lemezeken termesztett telepek vizsgálata, leírásuk. A telepek átlátszóak, áttetszők vagy átlátszatlanok lehetnek, különböző méretűek, lekerekített szabályos vagy szabálytalan körvonalak, domború vagy lapos alakúak, sima vagy érdes felületűek, sima vagy hullámos, szaggatott élek. Lehet színtelen vagy fehér, arany, piros, sárga. Ezen jellemzők vizsgálata alapján a felnőtt telepeket csoportokra osztják. Ezután egy izolált kolóniát választanak ki a vizsgálati csoportból, kenetet készítenek a mikroszkópos vizsgálathoz annak érdekében, hogy ellenőrizzék a telep mikrobáinak homogenitását. Ugyanezt a telepet oltják be egy kémcsőbe ferde tápanyag -agarral.
3. nap - az agaron ferde tenyészet tisztaságának ellenőrzése kenetmikroszkóppal. A vizsgált baktériumok homogenitása mellett a tiszta tenyészet izolálása teljesnek tekinthető.
Az izolált baktériumok azonosítása érdekében tanulmányozzák a kulturális tulajdonságokat, vagyis a folyékony és szilárd táptalajokon való növekedés jellegét. Például a cukorlevesben lévő streptococcusok alsó és parietális üledéket képeznek, a vér agaron - kicsi, pontos telepeket; a kolera vibrio fóliát képez az alkalikus peptonvíz felszínén, és átlátszó telepeket alkálikus agaron; a pestisbacillus tápláló agaron "csipke zsebkendők" formájában gyarmatokat képez, sűrű központtal és vékony hullámos szélekkel, és folyékony táptalajban - film a felületen, majd szálak, amelyek "stalaktitok" formájában nyúlnak ki ".
Anaerob baktériumok tiszta tenyészetének tenyésztése és izolálása
Az anaerobok tenyésztéséhez csökkenteni kell a közeg oxidációs-redukciós potenciálját, anaerobiosist kell létrehozni az oxigén fizikai, kémiai vagy biológiai módszerekkel történő eltávolításával.
A fizikai módszerek a következők:
1) a levegő mechanikus eltávolítása szivattyú segítségével az anae-rostatból, amelybe oltott edényeket helyeznek. Ugyanakkor a levegőt közömbös gázzal helyettesítheti: nitrogén, hidrogén, szén -dioxid.
2) redukáló anyagokat tartalmazó tápközegben való termesztés. A Kitta-Tarozzi szerda cukorleves máj- vagy húsdarabokkal. A glükóz és a szervdarabok redukáló képességgel rendelkeznek. A közeget ráöntjük egy réteg vazelinolajjal, hogy megakadályozzuk a levegő oxigénjének hozzáférését.
3) A legegyszerűbb, de kevésbé megbízható módszer az, ha mélyen nő egy magas cukor agar oszlopban.
A kémiai módszerek abból a tényből állnak, hogy az anaerob növényeket tartalmazó edényeket hermetikusan lezárt exszikkátorba helyezik, ahol vegyszereket helyeznek el, például pirogallolt és lúgot, amelyek között a reakció oxigén felszívódásával folytatódik.
A biológiai módszer alapja az anaerobok és aerobok egyidejű tenyésztése szilárd táptalajokon Petri -csészékben, hermetikusan lezárva az oltás után. Először az oxigént szívják fel a növekvő aerobok, majd megkezdődik az anaerobok növekedése.
A tiszta anaerob tenyészet izolálása az anaerob baktériumok felhalmozódásával kezdődik Kitta-Tarozzi táptalajra történő beoltással. A jövőben az izolált telepeket kétféleképpen lehet megszerezni:
1) az anyagot oltott meleg cukor agarral üvegcsövekben összekeverve oltjuk be. Az agar megszilárdulása után elszigetelt telepek nőnek a mélyén, amelyeket a cső átvágásával távolítanak el, és Kitt-Tarozzi táptalajon tenyésztenek (Weinberg módszer);
2) az anyag beoltását tápközeggel ellátott lemezekre végezzük, és anaerosztátban inkubáljuk. A tányéron tenyésztett izolált telepeket Kitt-Tarozzi táptalajon (Zeissler módszer) szubkultúrázzuk.
Más mikroorganizmusok tenyésztése
A mikoplazmák tenyésztése
A mikoplazmákat szérummal és szénhidrátokkal kiegészített táptalajokon tenyésztik. Mivel a mikoplazmáknak nincs sejtfaluk, csak izotóniás vagy hipertóniás környezetben nőnek. Szilárd táptalajokon több napon keresztül nagyon kis telepek képződnek, amelyek hasonlítanak a sült tojásokhoz - domború központtal és lapos áttetsző perifériával. A mikoplazmákat csirkeembrióban vagy sejtkultúrában is lehet termeszteni.
A rickettsia és a chlamydia termesztése
A rickettsiae és a chlamydiae kötelező intracelluláris paraziták. Termesztésükhöz sejttenyészeteket, csirkeembriókat és állati fertőzést használnak.
Gomba termesztés
A gombatermesztéshez sűrű és folyékony táptalajokat használnak: leggyakrabban a Sabouraud táptalaját, valamint a sörlevet tartalmazó táptalajt. A gombák lassabban nőnek, mint a baktériumok, néhány napon belül látható növekedést képeznek. A tenyésztési hőmérséklet alacsonyabb, mint a baktériumoké - 22-30 ° C.
Spirochetek és protozoonok termesztése
A spirocheták közül a legegyszerűbb a leptospirák termesztése, amelyekhez a nyúl vérszérumával kevert víz tápanyagként szolgálhat.A borreliát és a treponemát anaerob körülmények között tenyésztik bonyolultabb táptalajokon, amelyek szérumot, állati szövetdarabokat tartalmaznak.
A protozoonok közül a dizentériás amőba, a lamblia, a Trichomonas, a leishmania, a trypanosome, a balantidia tenyészthető táptalajokon, a Toxoplasma csirkeembrióban és szövettenyészetben. A malária plazmodia tenyésztési módszerei fejlesztés alatt állnak.
Módszerek az enzimatikus aktivitás vizsgálatára (biokémiai tulajdonságok)
A mikrobiológiai gyakorlatban az enzimatikus aktivitás vizsgálatát használják a mikroorganizmusok azonosítására, mivel minden mikrobiális fajnak van egy bizonyos enzimkészlete.
A proteolitikus aktivitás meghatározásához a mikrobákat injektáljuk egy zselatinoszlopba, és 3-5 napos szobahőmérsékleten történő inkubálás után a zselatin cseppfolyósodásának jellegét figyeljük meg: tölcsér, köröm, harisnya formájában vagy felborult karácsonyfa formájában. A proteolitikus aktivitást a fehérje bomlástermékeinek képződése is meghatározza: indol, hidrogén -szulfid, ammónia. Ezek meghatározásához mikroorganizmusokat oltanak be hús-pepton húslevesbe, és indikátorpapírokat helyeznek a kémcső nyaka és egy pamut dugó közé, kizárva a közeggel való érintkezésüket. Indol képződésekor az oxálsav telített oldatával impregnált papír rózsaszínűvé válik; hidrogén -szulfid jelenlétében az ólom -acetáttal impregnált papír feketére színeződik; ammónia képződésekor a piros lakmuszpapír kékre színeződik.
A mikrobák szacharolitikus tulajdonságainak meghatározásához differenciáldiagnosztikai közegeket használnak, például Giss táptalajt, Olkenitsky táptalajt, Endo táptalajt, Levin táptalajt, Ploskirev táptalajt.
A Petri -csészékben használt Endo, Levin, Ploskirev médiákat a bélcsoport baktériumainak megkülönböztetésére használják a laktóz fermentációs képessége alapján. Ezek a közegek tápanyag agart, laktózt és egy indikátort tartalmaznak, amely megváltoztatja a színt egy savas közegben - a pH -indikátort. Ha ilyen környezetben vet el laktózt erjesztő baktériumokat, például E. coli -t, akkor a laktóz erjedése következtében sav képződik, és az indikátor savas környezetben színt vált. Ezért az ilyen táptalajon lévő Escherichia coli telepeket az indikátor színe szerint színezzük: Endo és Ploskirev táptalaján - piros színben, Levin táptalaján - fekete és kék színben. Azok a baktériumok, amelyek nem erjesztik a laktózt, például a szalmonella és a dizentéria botok, színtelenek lesznek.
A Giss táptalajokat („tarig range range”) peptonvíz vagy félig folyékony hús-pepton agar alapján készítik. Bármely szénhidrátot vagy többértékű alkoholt és egy mutatót tartalmazhat. Amikor egy mikrobák nőnek a Giss táptalajon, erjesztve ezt a szubsztrátot sav és gáz képződésével, a közeg színe megváltozik, félig folyékony közegben buborékok és repedések jelennek meg az agar vastagságában, folyékony közegben - a gázbuborék egy üveg úszóban. Ha a szubsztrátot csak savvá erjesztik, akkor csak a közeg színe változik meg.
Nem egy szénhidrátot, hanem kettőt vagy hármat tartalmazó kombinált közeget is használnak, például Olkenitsky táptalaját. Ennek a közegnek az egyik csöve helyettesíti az agar ferde és Giss táptalajokat laktózzal, glükózzal és szacharózzal. Olvadt állapotban végzett sterilizálás után a kémcsőben lévő közeget le kell ferdíteni úgy, hogy oszlopot és ferde részt kapjunk. A vetés a ferde részen egy mozdulattal, egy oszlopban szúrással történik. Laktóz vagy szacharóz erjesztésekor a teljes közeg színe megváltozik; ha egy glükózt erjesztenek, csak az oszlop színe változik. A gázképződést buborékok jelenléte jelzi az agar oszlopban. Amikor a mikrobák ammóniát bocsátanak ki, a közeg színe nem változik. A hidrogén -szulfid képződése az agar -táblázat feketedésével nyilvánul meg
A baktériumok enzimatikus aktivitásának meghatározására szolgáló expressz módszerhez mikroteszt -rendszereket és indikátorpapír -rendszert (NIB) használnak
A mikroteszt rendszer átlátszó polisztirolból készült edény, amely több sejtből áll. A sejtek szárított tápanyagot tartalmaznak szénhidrátokkal és pH -mutatókkal. Egy bizonyos sűrűségű baktériumkultúra szuszpenzióját oltják be minden sejtbe. Sóoldatot öntenek. színeket
indikátor
Az enterobacteriaceae család azonosítására szolgáló indikátorpapír -rendszerek (NIB) a kromatográfiás papír korongjai vagy csíkjai, amelyek védőfóliával vannak bevonva, és tartalmaznak egy specifikus hordozót és egy mutatót. Az indikátor színének megváltoztatásával A hidrogén -szulfid meghatározásához a korong az MPA felületére helyezve, injekcióval beoltva, amely lehetővé teszi a mobilitás egyidejű meghatározását
Minden csőben figyelembe veszik az ugyanazon a napon előzetes eredményt és a másnapi végeredményt.
Az oxidázaktivitást a tenyészet indikátorpapíron történő őrlésével határozzuk meg, és az eredményt egy perc múlva figyelembe vesszük.
A mikroorganizmusokat (a kötelező intracelluláris paraziták - rickettsia, chlamydia, vírusok és protozoonok) kivételével általában mesterséges táptalajokon tenyésztik. Az egyik vagy másik típusú táptalaj tápanyagszükségletétől függően a megfelelő műanyag- és energia -anyagcseréhez szükséges kiindulási anyagokat kell tartalmaznia.
A mikroorganizmusok különféle anyagokból történő izolálását és kultúrájuk előállítását széles körben használják a laboratóriumi gyakorlatban a fertőző betegségek mikrobiológiai diagnosztikájában, a kutatómunkában és a vakcinák, antibiotikumok és a mikrobiális létfontosságú tevékenység egyéb biológiailag aktív termékeinek mikrobiológiai előállításában.
A tenyésztési feltételek az adott mikroorganizmusok tulajdonságaitól is függenek. A legtöbb patogén mikrobát táptalajokon, 37 ° C -on 12 napon keresztül termesztik. Néhányuknak azonban hosszabb átfutási időre van szüksége. Például a szamárköhögés baktériumok - 2-3 nap alatt, és a mycobacterium tuberculosis - 3-4 hét alatt.
Az aerob mikrobák növekedési és szaporodási folyamatainak stimulálása, valamint a tenyésztési idő csökkentése érdekében a merített tenyésztési módszert alkalmazzák, amely a levegőztetésből és a tápközeg keveréséből áll. A mély módszer széles körben alkalmazható a biotechnológiában.
Az anaerobok termesztéséhez speciális módszereket alkalmaznak, amelyek lényege a levegő eltávolítása vagy inert gázokkal való helyettesítése a lezárt termosztátokban - anaerosztátok. Az anaerobokat redukáló anyagokat (glükóz, nátrium -formiát stb.) Tartalmazó táptalajokon tenyésztik, amelyek csökkentik a redoxpotenciált.
A diagnosztikai gyakorlatban különösen fontosak a tiszta baktériumtenyészetek, amelyeket a páciens vagy a környezeti tárgyak vizsgálati anyagából izolálnak. Ebből a célból mesterséges táptalajokat használnak, amelyeket a legkülönfélébb összetételű alap-, differenciáldiagnosztikai és választható közegekre osztanak. A tiszta tenyészet izolálásához szükséges tápközeg kiválasztása elengedhetetlen a bakteriológiai diagnózishoz.
A legtöbb esetben szilárd tenyésztő tápközeget használnak, amelyet korábban Petri -csészékbe öntöttek. A vizsgálati anyagot a tápközeg felületére hurokba helyezzük, és spatulával eldörzsöljük, hogy izolált telepeket kapjunk egy sejtből. Egy izolált kolónia szubkultúrája kémcsőben ferdén agaron lejtve tiszta tenyészetet eredményez.
Azonosításra, azaz A kiválasztott kultúra generikus és faji típusainak meghatározásához leggyakrabban a fenotípusos karaktereket tanulmányozzák:
a) a bakteriális sejtek morfológiája festett kenetekben vagy natív készítményekben;
b) a tenyészet biokémiai jelei a szénhidrátok (glükóz, laktóz, szacharóz, maltóz, mannit stb.) fermentációs képessége, indol, ammónia és hidrogén -szulfid képződése alapján, amelyek a baktériumok proteolitikus aktivitásának termékei.
A teljesebb elemzéshez gáz-folyadék kromatográfiát és más módszereket használnak.
A tiszta tenyészetek azonosítására szolgáló bakteriológiai módszerekkel együtt széles körben alkalmaznak immunológiai kutatási módszereket, amelyek az izolált tenyészet antigén szerkezetének tanulmányozását célozzák. Ebből a célból szerológiai reakciókat alkalmaznak: agglutináció, immunfluoreszcens kicsapás, komplementkötés, enzim immunvizsgálat, radioimmunassay módszerek stb.
-
Módszerek a tiszta tenyészet izolálására
A mikroorganizmusok tiszta tenyészetének izolálása érdekében el kell különíteni egymástól az anyagban található számos baktériumot. Ezt olyan módszerekkel lehet elérni, amelyek két elven alapulnak -mechanikai ésbiológiai a baktériumok disszociációja.
A tiszta tenyészetek izolálásának módszerei mechanikai elven alapulnak
Soros hígítási módszer, amelyet L. Pasteur javasolt, az egyik legelső volt, amelyet a mikroorganizmusok mechanikai elválasztására használtak. Ez egy mikrobiákat tartalmazó anyag sorozatos hígításának elvégzéséből állfolyékonytápközeg. Ez a technika meglehetősen fáradságos és tökéletlen a munkában, mivel nem teszi lehetővé a hígítás során a kémcsövekbe belépő mikrobiális sejtek számának szabályozását.
Ennek nincs hátrányaKoch módszer (lemezhígítási módszer). R. Koch zselatin vagy agar-agar alapú szilárd táptalajokat használt. A különböző típusú baktériumokat társító anyagot több kémcsőben hígítottuk olvasztott és kissé lehűtött zselatinnal, amelynek tartalmát később steril üveglapokra öntöttük. A tápközeg gélesedése után az optimális hőmérsékleten tenyésztették. Vastagságában mikroorganizmusok izolált kolóniái képződtek, amelyek platinahurok segítségével könnyen átvihetők friss tápközegbe, hogy tiszta baktériumtenyészetet kapjanak.
Drygalski módszereegy fejlettebb módszer, amelyet széles körben alkalmaznak a mindennapi mikrobiológiai gyakorlatban. Először a vizsgálati anyagot pipettával vagy hurokkal Petri -csészében a közeg felületére kell felhordani. Fém- vagy üveglapát segítségével alaposan dörzsölje a közegbe. Az edényt nyitva kell tartani a vetés során, és óvatosan el kell forgatni, hogy egyenletesen ossza el az anyagot. A spatula sterilizálása nélkül a kölcsönzött anyagot egy másik Petri -csészében hajtják végre, ha szükséges, egy harmadikban. A spatulát csak ezután mártjuk fertőtlenítő oldatba, vagy égő lángban megsütjük. A táptalaj felszínén az első edényben általában a baktériumok folyamatos növekedését figyeljük meg, a másodikban - sűrű növekedést, a harmadikban - elszigetelt telepek formájában.
Drigalski módszer telepek
Vonaltenyésztési módszerma leggyakrabban mikrobiológiai laboratóriumokban használják. A mikroorganizmusokat tartalmazó anyagot bakteriológiai hurokkal gyűjtik össze, és a táptalaj felületére viszik fel az edény széléhez közel. Távolítsa el a felesleges anyagot, és tartsa párhuzamos mozdulatokkal a csésze szélétől a széléig. Az oltások optimális hőmérsékleten történő egynapos inkubálása után az edény felületén elszaporodnak a mikrobák.
Stroke módszer
Az izolált telepek megszerzéséhez használjon fedett tampont, amelyet a vizsgálati anyag összegyűjtésére használtak. Nyissa ki egy kicsit a Petri -csészét a táptalajjal, helyezzen bele egy tampont, és óvatos mozdulatokkal dörzsölje az anyagot az edény felületébe, fokozatosan visszaadva a tampont és az edényt.
Így a lemezhígítások Koch, Drygalsky és csíkos tenyésztési módszereinek jelentős előnye, hogy izolált mikroorganizmus -kolóniákat hoznak létre, amelyeket egy másik tápközegbe beoltva tiszta tenyészetré alakulnak.
Biológiai módszerek tiszta tenyészetek izolálására
A baktériumok szétválasztásának biológiai elve céltudatosan keresi azokat a módszereket, amelyek figyelembe veszik a mikrobiális sejtek számos jellemzőjét. A leggyakoribb módszerek közé tartoznak a következők:
1. A légzés típusa szerint. A légzés típusa szerint minden mikroorganizmus két fő csoportra oszlik:aerobic (Corynebacterium diphtheriaeVibrio hoholerae stb) ésanaerob (Clostridium tetaniClostridium botulinumClostridium perfringens satöbbi.)... Ha az anyagot, amelyből az anaerob kórokozókat el kell különíteni, előmelegítik, majd anaerob körülmények között tenyésztik, akkor ezek a baktériumok növekedni fognak.
2. Bysporuláció. Ismeretes, hogy egyes mikrobák (bacilusok és klostridiák) képesek termékenységre. KözöttükClostridium tetaniClostridium botulinumClostridium perfringensBacillus subtilisBacillus cereus... A viták ellenállnak a környezeti tényezők hatásának. Következésképpen a vizsgálati anyagot termikus tényező hatásának lehet kitenni, majd oltva át lehet vinni a tápközegbe. Egy idő után pontosan azok a baktériumok fognak növekedni, amelyek képesek a termékenységre.
3. A mikrobák ellenállása savakkal és lúgokkal szemben. Néhány kórokozó(Mycobacterium tuberculosisMycobacterium bovis) kémiai szerkezetük sajátosságai miatt ellenállnak a savak hatásának. Ezért az azokat tartalmazó anyagot, például a köpetet tuberkulózisban, egyenlő térfogatú 10% -os kénsavoldattal előkezelik, majd táptalajra vetik. Az idegen növényzet elpusztul, és a mikobaktériumok savakkal szembeni ellenállásuk következtében növekednek.
Kolera vibrio(Vibrio hoholerae)ellenkezőleg, halofil baktérium, ezért az optimális növekedési feltételek megteremtéséhez lúgot (1% lúgos peptonvizet) tartalmazó táptalajra kell vetni. 4-6 órán belül a növekedés jellegzetes jelei jelennek meg a táptalaj felületén finom kékes film formájában.
4. A baktériumok mobilitása. Néhány kórokozó(Proteus vulgaris) hajlamosak a kúszásra, és képesek gyorsan elterjedni valami nedves felületén. Az ilyen kórokozók elkülönítésére egy csepp kondenzációs folyadékot inokulálnak, amely az agar ferde lehűlésekor keletkezik. 16-18 év után elterjedtek a környezet teljes felületén. Ha az agar tetejéről veszünk anyagot, tiszta kórokozó tenyészetünk lesz.
5. A mikrobák érzékenysége a vegyi anyagok, antibiotikumok és más antimikrobiális szerek hatására.A baktériumok anyagcseréjének jellemzőiből adódóan különböző kémiai tényezőkkel szembeni érzékenységük eltérő lehet. Ismeretes, hogy a staphylococcusok, a spórákat képező aerob bacilusok 7,5-10% -os nátrium-klorid hatásával szemben ellenállóak. Ezért ezeknek a kórokozóknak az elkülönítésére elektív táptalajokat (sárgás-sós agar, beckon-só agar) használnak, amelyek ezt az anyagot tartalmazzák. Más baktériumok gyakorlatilag nem nőnek ilyen koncentrációban a nátrium -kloridban.
6. Néhány antibiotikum beadása(nisztatin) a gombák szaporodásának gátlására szolgál azokkal erősen szennyezett anyagokban. Ezzel szemben a penicillin antibiotikum hozzáadása elősegíti a baktériumflóra növekedését, ha gombákat kell izolálni. A furazolidon bizonyos koncentrációkban történő hozzáadása a tápközeghez szelektív feltételeket teremt a korinebaktériumok és a mikrokokokok szaporodásához.
7. A mikroorganizmusok azon képessége, hogy ép bőrön keresztül behatoljanak. Néhány kórokozó baktérium(Yersinia pestis) nagyszámú agresszív enzim jelenléte következtében képesek behatolni az ép bőrön. Ehhez a laboratóriumi állat testén lévő gyapjút leborotválják, és a vizsgálati anyagot erre a területre dörzsölik, amely tartalmazza a kórokozót és nagy mennyiségű harmadik fél mikroflóráját. Egy idő után az állatot levágják, és a vérből vagy a belső szervekből mikrobák szabadulnak fel.
8. A laboratóriumi állatok érzékenysége a fertőző ágensekre.Egyes állatok nagyon érzékenyek a különböző mikroorganizmusokra.
Például bármilyen beadási módszerrelStreptococcus pneumoniaefehér egerekben általános pneumococcus fertőzés alakul ki. Hasonló kép figyelhető meg, amikor a tengerimalacokat tuberkulózis kórokozóival fertőzik meg.(Mycobacterium tuberculosis).
A mindennapi gyakorlatban a bakteriológusok olyan fogalmakat használnak, minttörzséstiszta kultúramikroorganizmusok. Egy törzs alatt ugyanazon faj mikrobáit értjük, amelyeket különböző forrásokból vagy ugyanabból a forrásból, de különböző időpontokban izoláltak. A tiszta baktériumkultúra ugyanazon faj mikroorganizmusai, egy mikrobiális sejt leszármazottai, amelyek tápoldaton (vagy) növekedtek.
A tiszta kultúra izolálása aerobny mikroorganizmusok több szakaszból áll.
Első nap(1. fázisú kutatás) a kóros anyagot steril tartályba (kémcsőbe, lombikba, palackba) visszük. Tanulmányozzák - megjelenés, textúra, szín, illat és egyéb jelek, kenetet készítenek, festenek és mikroszkóp alatt megvizsgálják. Bizonyos esetekben (akut gonorrhoea, pestis) ebben a szakaszban lehet előzetes diagnózist felállítani, és ezenkívül lehetőség van arra a közeg kiválasztására, amelyre az anyagot be kell oltani. Ezután bakteriológiai hurkot (leggyakrabban használt) hajtanak végre, spatula segítségével - Drygalsky módszerrel, pamut gézzel. A csészéket lezárják, fejjel lefelé fordítják, speciális ceruzával aláírják, és optimális hőmérsékletű (37 ° C) termosztátba helyezik 18-48 órára. Ennek a szakasznak a célja a mikroorganizmusok izolált kolóniáinak megszerzése.
Néha azonban az anyag felhalmozása érdekében folyékony táptalajra vetik.
A második napon(2. szakasz kutatása) a sűrű tápközeg felszínén a mikroorganizmusok folyamatos, sűrű növekedést vagy elszigetelt telepeket képeznek.A gyarmat - Ezek a szabad szemmel látható baktériumok felhalmozódása a felszínen vagy a tápközeg vastagságában. Általában minden kolónia egy mikrobiális sejt leszármazottaiból (klónok) képződik, ezért összetételük meglehetősen homogén. A baktériumok táptalajokon való növekedésének jellemzői kulturális tulajdonságaik megnyilvánulása.
A lemezeket alaposan megvizsgáljuk és megvizsgáljuk az agar felületén nőtt izolált telepeket. Ügyeljen a telepek széleinek és felületének méretére, alakjára, színére, jellegére, konzisztenciájára és egyéb jellemzőire. Ha szükséges, vizsgálja meg a telepeket nagyító alatt, a mikroszkóp kis vagy nagy nagyításával. A telepek szerkezetét áteresztő fényben, a mikroszkóp kis nagyításában vizsgáljuk. Lehetnek hialin, szemcsés, fonalas vagy rostosak, amelyekre jellemző, hogy a telepek vastagságában összefonódó szálak vannak jelen.
A telepek jellemzése fontos része a bakteriológus és laboratóriumi asszisztens munkájának, mivel az egyes fajok mikroorganizmusai saját speciális kolóniákkal rendelkeznek.
A harmadik napon(3. fázisú kutatás) tanulmányozza a mikroorganizmusok tiszta kultúrájának növekedésének jellegét, és végezze el azonosítását.
Először is figyelnek a mikroorganizmusok szaporodásának sajátosságaira a táptalajon, és kenetet készítenek, festve azt Gram módszerrel, annak érdekében, hogy ellenőrizzék a tenyészet tisztaságát. Ha mikroszkóp alatt azonos típusú morfológiájú, méretű és tinktoriális (festési képességű) baktériumokat figyelünk meg, akkor arra a következtetésre jutunk, hogy a tenyészet tiszta. Bizonyos esetekben már megjelenésükben és növekedésük jellemzőiben levonhatjuk a következtetést az izolált kórokozók típusáról. A baktériumok típusának morfológiai jellemzőik alapján történő meghatározását morfológiai azonosításnak nevezzük.A kórokozók típusának kulturális jellemzőik alapján történő meghatározását kulturális azonosításnak nevezzük.
Ezek a tanulmányok azonban nem elegendőek ahhoz, hogy végső következtetést vonjunk le az izolált mikrobák típusáról. Ezért tanulmányozzák a baktériumok biokémiai tulajdonságait. Elég változatosak.
-
A baktériumok azonosítása.
A kórokozó típusának biokémiai tulajdonságai alapján történő meghatározását ún biokémiai azonosítás.
A baktériumfajok megállapítása érdekében gyakran tanulmányozzák azok antigén szerkezetét, vagyis antigén tulajdonságok alapján azonosítják őket. Minden mikroorganizmus különböző antigén anyagokat tartalmaz. Különösen az enterobacteriaceae család képviselői (Yesherichia, Salmoneli, Shigela) tartalmaznak membrán O-antigént, flagellate H-antigént és kapszuláris K-antigént. Kémiai összetételükben heterogének, ezért számos változatban léteznek. Ezeket meghatározott agglutináló szérumok segítségével lehet meghatározni. Ezt a baktériumtípus -meghatározást nevezik szerológiai azonosítás.
Néha a baktériumokat úgy azonosítják, hogy a laboratóriumi állatokat tiszta kultúrával megfertőzik, és megfigyelik a kórokozók által a szervezetben okozott változásokat (tuberkulózis, botulizmus, tetanusz, szalmonellózis stb.). Ezt a módszert ún biológiai tulajdonságok alapján történő azonosítás... Tárgyakként - tengerimalacokat, fehér egereket és patkányokat használnak leggyakrabban.
MELLÉKLETEK
(táblázatok és diagramok)
A baktériumok élettana
Séma 1. A baktériumok élettana.
táplálás
lehelet
magasság
reprodukció
táptalajokon nő
1. táblázat: A bakteriális élettan általános táblázata.
|
№ |
Koncepció |
Jellegzetes |
|
Táplálás |
Az energia és az anyagok megszerzésének folyamata. |
|
|
Lehelet |
Biokémiai folyamatok halmaza, amelynek eredményeként a mikrobiális sejtek létfontosságú tevékenységéhez szükséges energia felszabadul. |
|
|
Magasság |
Az összes sejtkomponens és szerkezet összehangolt reprodukciója, ami végső soron a sejttömeg növekedéséhez vezet |
|
|
Reprodukció |
A sejtek számának növekedése a populációban |
|
|
Növekvő táptalajokon. |
Laboratóriumi körülmények között a mikroorganizmusokat olyan táptalajokon tenyésztik, amelyeknek sterilnek, átlátszónak, nedvesnek kell lenniük, bizonyos tápanyagokat (fehérjék, szénhidrátok, vitaminok, nyomelemek stb.) Kell tartalmazniuk, bizonyos pufferkapacitással, megfelelő pH -értékkel, redoxpotenciállal kell rendelkezniük. |
1.1. Táblázat Az elemek kémiai összetétele és élettani funkciói.
|
№ |
Összetétel elem |
A sejtélettan jellemzői és szerepe. |
|
|
Víz |
A baktériumsejt fő alkotóeleme, tömege körülbelül 80% -át teszi ki. Szabad vagy kötött állapotban van a cella szerkezeti elemeivel. A vitákban a víz mennyisége 18,20%-ra csökken. A víz sok anyag oldószere, és mechanikai szerepet is betölt a turgor biztosításában. A plazmolízis során - a sejt vízvesztése hipertóniás oldatban - a protoplazma leválik a sejtmembránról. Víz eltávolítása a sejtből, szárítás, felfüggeszti az anyagcsere folyamatokat. A legtöbb mikroorganizmus jól tolerálja a szárítást. Vízhiány esetén a mikroorganizmusok nem szaporodnak. A fagyasztott állapotból történő vákuumban történő szárítás (liofilizálás) leállítja a reprodukciót, és elősegíti a mikrobiális egyedek hosszú távú megőrzését. |
||
|
Fehérje |
40-80% szárazanyag. Ezek határozzák meg a baktériumok legfontosabb biológiai tulajdonságait, és általában 20 aminosav kombinációjából állnak. A baktériumok közé tartozik a diaminopimelsav (DAP), amely emberi és állati sejtekben nincs jelen. A baktériumok több mint 2000 különböző fehérjét tartalmaznak, amelyek megtalálhatók a szerkezeti elemekben és részt vesznek az anyagcsere folyamatokban. A legtöbb fehérje enzimatikus aktivitással rendelkezik.A baktériumsejt fehérjéi határozzák meg az antigenitást és immunogenitást, a virulenciát és a baktériumfajokat. |
||
|
№ |
Összetétel elem |
A sejtélettan jellemzői és szerepe. |
|
|
Nukleinsavak |
Az eukarióta sejtek nukleinsavaihoz hasonló funkciókat látnak el: a kromoszóma formájában lévő DNS -molekula felelős az öröklődésért, a ribonukleinsavak (információs vagy mátrix, transzport és riboszómális) részt vesznek a fehérjék bioszintézisében. |
||
|
Szénhidrátok |
Ezeket egyszerű anyagok (mono- és diszacharidok) és komplex vegyületek képviselik. A poliszacharidok gyakran kapszulákban találhatók. Néhány intracelluláris poliszacharid (keményítő, glikogén stb.) Tartalék tápanyag. |
||
|
Lipidek |
Ezek a citoplazmatikus membrán és származékai részei, valamint a baktériumok sejtfala, például a külső membrán, ahol a lipidek biomolekuláris rétege mellett LPS is található. A lipidek a citoplazmában tartalék tápanyagok szerepét tölthetik be. A bakteriális lipideket foszfolipidek, zsírsavak és gliceridek képviselik. A Mycobacterium tuberculosis tartalmazza a legnagyobb mennyiségű lipidet (akár 40%). |
||
|
Ásványok |
A hamuban megtalálható a sejtek elégetése után. A foszfor, kálium, nátrium, kén, vas, kalcium, magnézium, valamint nyomelemek (cink, réz, kobalt, bárium, mangán stb.) Nagy mennyiségben kimutathatók. Részt vesznek az ozmotikus nyomás, a pH szabályozásában a táptalajból, a redoxpotenciálból aktiválja az enzimeket, az enzimek, vitaminok és a mikrobiális sejtek szerkezeti összetevőinek része. |
||
1.2. Táblázat Nitrogén bázisok.
|
№ |
Nitrogén bázisok |
Jellegzetes |
jegyzet |
|
Purin |
Adenin, Guanin |
Nukleotid összetétel: dezoxiribóz, nitrogénbázisok - adenin, guanin, citozin, timin, H3PO4 maradék. A nitrogénbázisok komplementaritása A = T, G = C. Kettős spirál. Képes önmegduplázódni |
|
|
Pirimidin |
Citozin, Timin vagy Uracil (RNS -hez Timin helyett) |
1.2.1. Táblázat: Enzimek
|
№ |
Jel |
Jellegzetes |
|
|
Meghatározás |
Specifikus és hatékony fehérje katalizátorok minden élő sejtben. |
||
|
Funkciók |
Az enzimek csökkentik az aktiválási energiát, olyan kémiai reakciók bekövetkezését biztosítják, amelyek nélkülük csak magas hőmérsékleten, túlzott nyomáson és más, nem élettani körülmények között, az élő sejt számára elfogadhatatlan körülmények között játszódhatnak le. |
||
|
Az enzimek körülbelül 10 nagyságrenddel növelik a reakciósebességet, ami 300 évről egy másodpercre csökkenti bármely reakció felezési idejét. |
|||
|
Az enzimek "felismerik" a szubsztrátot a molekula térbeli elrendezése és a benne lévő töltések eloszlása alapján. Az enzimatikus fehérje molekula bizonyos része - annak katalitikus központja - felelős a szubsztráthoz való kötődésért. Ebben az esetben egy közbenső enzim-szubsztrát komplex képződik, amely ezután reakciótermék és szabad enzim képződésével bomlik. |
|||
|
Fajták |
A szabályozó (alloszterikus) enzimek különféle metabolikus jeleket észlelnek, és ezeknek megfelelően megváltoztatják katalitikus aktivitásukat. |
Effektor enzimek - bizonyos reakciókatalizáló enzimek (további részletekért lásd az 1.2.2. Táblázatot). |
|
|
Funkcionális tevékenység |
Az enzimek funkcionális aktivitása és az enzimatikus reakciók sebessége függ a mikroorganizmus elhelyezkedésének körülményeitől és mindenekelőtt a közeg hőmérsékletétől és pH -értékétől. Sok patogén mikroorganizmus esetében az optimális hőmérséklet 37 ° C és pH 7,2-7,4. |
||
ENZIMMEGOSZTÁSOK:
-
a mikroorganizmusok mind a hat ismert osztályba tartozó különféle enzimeket szintetizálnak.
1.2.2. Táblázat Az effektor enzimek osztályai
|
№ |
Enzim osztály |
Katalizál: |
|
Oxidoreduktáz |
Elektron transzfer |
|
|
Transzferázok |
Különféle kémiai csoportok átadása |
|
|
Hidrolázok |
Funkcionális csoportok átvitele egy vízmolekulába |
|
|
Lyases |
Csoportok kötődése kettős kötésekhez és fordított reakciókhoz |
|
|
Izomeráz |
Csoportok átvitele egy molekulán belül izomer formák képződésével |
|
|
Ligázok |
C-C, C-S, C-O, C-N kötések kialakulása az adenozin-trifoszfát (ATP) bomlásához kapcsolódó kondenzációs reakciók miatt |
Táblázat: 1.2.3. Az enzimek típusai baktériumsejtekben történő képződéssel
|
№ |
Típusú |
Jellegzetes |
Jegyzetek (szerkesztés) |
|
Iiducible (adaptív) enzimek "Aljzat indukció" |
|
||
|
Represszív enzimek |
Ezen enzimek szintézise leáll, mivel az enzim által katalizált reakciótermék túlzottan felhalmozódik. |
Az enzimelnyomás példája a triptofán szintézise, amely antranilsavból képződik, antranilát szintetáz részvételével. |
|
|
Létrehozó enzimek |
A környezeti feltételektől függetlenül szintetizált enzimek |
Glikolízis enzimek |
|
|
Több enzim komplexek |
Az intracelluláris enzimek szerkezetileg és funkcionálisan kombinálódnak |
Légzőlánc enzimek a citoplazmatikus membránon. |
1.2.4. Táblázat Specifikus enzimek
|
№ |
Enzimek |
A baktériumok azonosítása |
|
Szuperoxid -diszmutáz és kataláz |
Minden aerob vagy fakultatív anaerob szuperoxid -diszmutázt és katalázokat tartalmaz - enzimeket, amelyek megvédik a sejtet az oxigén -anyagcsere mérgező termékeitől. Szinte minden kötelező anaerob nem szintetizálja ezeket az enzimeket. Az aerob baktériumok csak egy csoportja - a tejsavbaktériumok kataláz -negatívak. |
|
|
Peroxidáz |
A tejsavbaktériumok felhalmozzák a peroxidázt, egy enzimet, amely katalizálja a szerves vegyületek oxidációját H2O2 hatására (vízre redukálva). |
|
|
Arginin -dihidroláz |
Diagnosztikai funkció, amely lehetővé teszi a szaprofita Pseudomonas fajok megkülönböztetését a fitopatogén fajoktól. |
|
|
Ureaza |
Az Enterobacteriaceae család öt fő csoportja közül csak kettő - Escherichiae és Erwiniae - nem szintetizálja az ureázt. |
1.2.5. Táblázat Bakteriális enzimek alkalmazása az ipari mikrobiológiában.
|
№ |
Enzimek |
Alkalmazás |
|
Amiláz, celluláz, proteáz, lipáz |
Az emésztés javítására olyan enzimkészítményeket használnak, amelyek megkönnyítik a keményítő, a cellulóz, a fehérje és a lipidek hidrolízisét. |
|
|
Élesztő invertáz |
Édességek gyártásában, hogy megakadályozzák a szacharóz kristályosodását |
|
|
Pektináz |
Gyümölcslevek tisztítására használják |
|
|
A clostridium és a streptococcusok streptokináz kollagénáza |
Hidrolizálja a fehérjéket, elősegíti a sebek és égési sérülések gyógyulását |
|
|
A baktériumok lítikus enzimjei |
Ezek kiválasztódnak a környezetbe, hatnak a patogén mikroorganizmusok sejtfalaira, és hatékony eszközként szolgálnak az utóbbiak elleni küzdelemben, még akkor is, ha többszörös antibiotikum -rezisztenciájuk van |
|
|
Ribonukleázok, dezoxiribonukleázok, polimerázok, DNS -ligázok és más enzimek, amelyek specifikusan módosítják a nukleinsavakat |
A bioorganikus kémia, a géntechnológia és a génterápia eszköztáraként használják |
1.2.6. Táblázat Az enzimek osztályozása lokalizáció szerint.
|
№ |
Osztály |
Lokalizáció |
Funkciók |
|
Endozimek |
|
Csak a sejt belsejében működnek. Katalizálják a bioszintézis és az energia -anyagcsere reakcióit. |
|
|
Exozimek |
A környezetbe kerülnek. |
Ezeket a sejt kibocsátja a környezetbe, és katalizálja a komplex szerves vegyületek hidrolízisének reakcióit egyszerűbbekké, amelyek a mikrobiális sejt asszimilációjához rendelkezésre állnak. Ide tartoznak a hidrolitikus enzimek, amelyek rendkívül fontos szerepet játszanak a mikroorganizmusok táplálkozásában. |
1.2.7. TáblázatKórokozó mikrobák enzimjei (agresszív enzimek)
|
№ |
Enzimek |
Funkció |
Egyes enzimek képződése a laboratóriumban |
|
Lecitovitellase = lecitináz |
Elpusztítja a sejtmembránokat |
|
|
|
Hemolizin |
Elpusztítja a vörösvértesteket |
|
|
|
Koaguláz-pozitív kultúrák |
A vérplazma alvadását okozza |
|
|
|
Koaguláz-negatív kultúrák |
Mannit előállítása |
|
|
|
№ |
Enzimek |
Funkció |
Egyes enzimek képződése a laboratóriumban |
|
Hialuronidáz |
Hidrolizálja a hialuronsavat - a kötőszövet fő összetevőjét |
|
|
|
Neuraminidáz |
Lehasítja a sziál (neuraminsavat) savat a különböző glikoproteinekből, glikolipidekből, poliszacharidokból, növelve a különböző szövetek permeabilitását. |
Detektálás: a neuraminidáz (RINA) és mások elleni antitestek meghatározására szolgáló reakció (immundiffúzió, immunenzimatikus és radioimmun módszerek). |
1.2.8. Táblázat Az enzimek osztályozása biokémiai tulajdonságok szerint.
|
№ |
Enzimek |
Funkció |
Érzékelés |
|
Sugarolitikus |
A cukrok lebontása |
Differenciál - diagnosztikai környezetek, mint például a Giss környezet, Olkenitsky környezete, Endo környezete, Levin környezete, Ploskirev környezete. |
|
|
Proteolitikus |
Fehérjék lebomlása |
A mikrobákat injektáljuk egy zselatinoszlopba, és 3-5 napos szobahőmérsékleten történő inkubálás után a zselatin cseppfolyósodásának jellegét észlelik. A proteolitikus aktivitást meghatározza a fehérje bomlástermékeinek képződése is: indol, hidrogén -szulfid, ammónia. Ezek meghatározásához mikroorganizmusokat oltanak be hús-pepton húslevesbe. |
|
|
Végtermék enzimek |
|
Annak érdekében, hogy enzimatikus aktivitásuk alapján megkülönböztessük a baktériumok egyes típusait a másiktóldifferenciáldiagnosztikai környezetek |
1.2.8. Az enzim összetétele.
MINDEN MIKROORGANIZMUS ENZIMIKUS ÖSSZETÉTELE:
Genomja határozza meg
Stabil jel
Széles körben használják azonosításukhoz
Szacharolitikus, proteolitikus és egyéb tulajdonságok meghatározása.
1.3. Táblázat Pigmentek
|
№ |
Pigmentek |
Mikroorganizmusok szintézise |
|
Zsírban oldódó karotinoid pigmentek piros, narancs vagy sárga színben |
Sarkinokat, mycobacterium tuberculosis -t és néhány aktinomicetát képezhetnek. Ezek a pigmentek megvédik őket az UV sugaraktól. |
|
|
Fekete vagy barna pigmentek - melaninok |
Kötelező anaerobok, Bacteroides niger és mások által szintetizált, vízben és még erős savakban is oldhatatlan |
|
|
Világos vörös pirrolpigment - prodigiosin |
Néhány szekció alakította ki |
|
|
Vízben oldódó fenozin pigment - piocianin. |
Pseudomonas aeruginosa baktériumok termelik (Pseudomonas aeruginosa). Ebben az esetben a semleges vagy lúgos pH-jú tenyésztőközeg kékeszöldre változik. |
1.4. Táblázat Fényes és aromaképző mikroorganizmusok
|
№ |
Jelenség |
Állapot és jellemző |
|
Ragyogás (lumineszcencia) |
A baktériumok azoknak a szubsztrátoknak a lumineszcenciáját okozzák, mint például a halpikkelyek, a magasabb gombák, a rothadó fák, az élelmiszerek, amelyek felszínén szaporodnak.A legtöbb lumineszcens baktérium halofil faj, amelyek megnövekedett sókoncentrációban szaporodhatnak. Tengerekben és óceánokban élnek, ritkán édes víztestekben. Minden lumineszcens baktérium aerob. A lumineszcenciás mechanizmus az energia felszabadulásával jár a szubsztrát biológiai oxidációja során. |
|
|
Aroma kialakulása |
Egyes mikroorganizmusok illékony aromaanyagokat, például etil -acetátot és amil -ecetsav -észtert termelnek, amelyek aromát kölcsönöznek a bornak, a sörnek, a tejsavnak és más élelmiszertermékeknek, ezért felhasználják az előállításukhoz. |
Táblázat: Metabolizmus 2.1.1
|
№ |
Koncepció |
Meghatározás |
|
|
Anyagcsere |
A sejt biokémiai folyamatait egyetlen szó - az anyagcsere (görög metabol - transzformáció) egyesíti. Ez a kifejezés egyenértékű az "anyagcsere és energia" fogalmával. Az anyagcserének két aspektusa van: az anabolizmus és a katabolizmus. |
||
|
|
||
|
Kétéltűség |
A köztes anyagcserét, amely a kis molekulatömegű tápanyag -töredékeket számos szerves savvá és foszforsav -észterré alakítja, ún. |
||
2.1.1. Anyagcsere
METABOLISM -
két ellentétes, de kölcsönhatásba lépő folyamat halmaza: katabolizmus és anabolizmus
val vel
Anabolizmus= asszimiláció = plasztikus anyagcsere = konstruktív anyagcsere
Katabolizmus= disszimiláció = energia -anyagcsere = bomlás = a sejt energiával való ellátása
Szintézis (sejtkomponensek)
Az enzimatikus katabolikus reakciók következményei energia felszabadítása, amely felhalmozódott az ATP molekulákban.
A monomerek bioszintézise:
zsírsav -monoszacharidok aminosavai nukleotidjai
Polimer bioszintézis:
nukleinsavfehérjék, lipid poliszacharidok
Egy enzimatikus anabolikus reakció eredményeként a katabolizmus során felszabaduló energiát a szerves vegyületek makromolekuláinak szintézisére fordítják, amelyekből ezután biopolimereket állítanak össze - a mikrobiális sejt összetevőit.
Az energiát a sejtkomponensek szintézisére fordítják
Táblázat: 2.1.3. A sejtenergia metabolizmusa és átalakulása.
|
№ |
Anyagcsere |
Jellegzetes |
Jegyzetek (szerkesztés) |
|
Funkció |
Az anyagcsere dinamikus egyensúlyt biztosít az élő szervezetben, mint rendszerben, amelyben a szintézis és a pusztítás, a szaporodás és a halál kölcsönösen kiegyensúlyozott. |
Az anyagcsere az élet fő jele |
|
|
Műanyag csere Fehérjék, zsírok, szénhidrátok szintézise. |
Ez a biológiai szintézisreakciók halmaza. |
A sejtekbe kívülről belépő anyagokból molekulák képződnek, hasonlóak a sejt vegyületeihez, vagyis asszimiláció következik be. |
|
|
Energiacsere hanyatlás |
A szintézissel ellentétes folyamat. Ez a hasítási reakciók gyűjteménye. |
A nagy molekulatömegű vegyületek feldarabolásakor energia szabadul fel, ami a bioszintézis reakciójához szükséges, vagyis disszimiláció következik be.
|
Táblázat: 2.1.2. Az anyagcsere különbsége az azonosításhoz.
|
№ |
Lehetőségek |
|
Különféle anyagok szénforrásként történő felhasználásának képessége. |
|
|
Az a képesség, hogy a szubsztrátok bomlása következtében meghatározott végtermékeket képezzenek. |
|
|
Az a képesség, hogy a tenyésztőközeg pH -ját a savas vagy lúgos oldathoz keverjük.A legtöbb baktérium anyagcseréjét biokémiai reakciók végzik a szerves (ritkábban szervetlen) anyagok bomlása és a baktériumsejtek összetevőinek egyszerű széntartalmú vegyületekből történő szintézise révén. |
2.2. Táblázat: Anabolizmus (konstruktív anyagcsere)
|
№ |
Anabolikus reakciócsoport |
Szintetizált: |
|
A monomerek bioszintézise |
Aminosavak, nukleotidok, monoszacharidok, zsírsavak |
|
|
Polimer bioszintézis |
Fehérjék, nukleinsavak, poliszacharidok és lipidek |
2.2.2. Aminosavak bioszintézise prokariótákban.
Szerző - L.B. Borisov, 52. o. "Orvosi mikrobiológia"

2.2.1. A szénhidrátok bioszintézise mikroorganizmusokban.
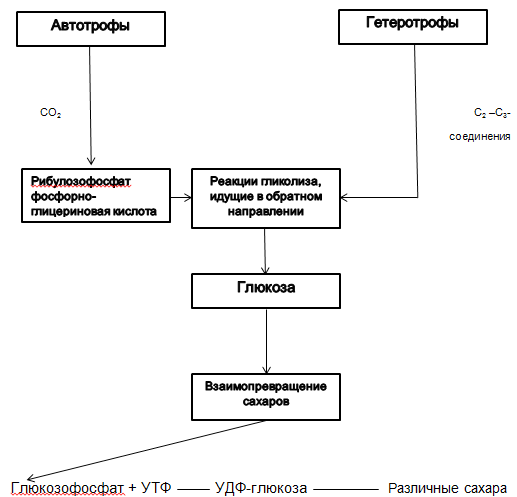
Szerző - L.B. Borisov, 51. o. "Orvosi mikrobiológia"
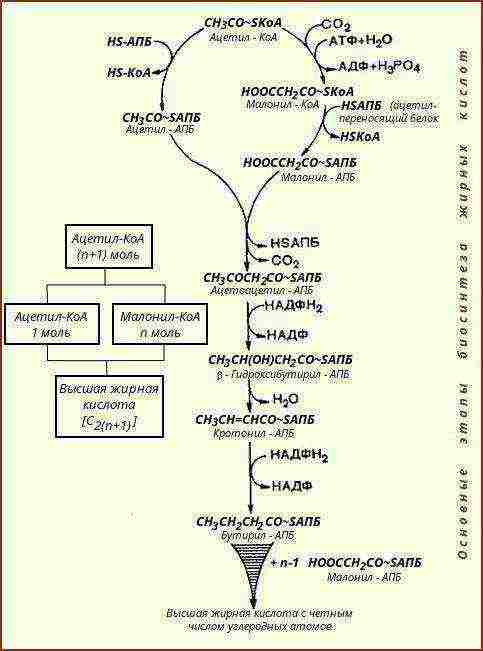
2.2.3. Lipid bioszintézis
2.2.4. Táblázat Az energia -anyagcsere szakaszai - Katabolizmus.
|
№ |
Szakasz |
Jellegzetes |
jegyzet |
|
Előkészítő |
A diszacharidok és poliszacharidok, fehérjék molekulái kis molekulákra bomlanak - glükóz, glicerin és zsírsavak, aminosavak. Nagy nukleinsavmolekulák nukleotidonként. |
Ebben a szakaszban kis mennyiségű energia szabadul fel, amely hő formájában eloszlik. |
|
|
Anoxikus vagy hiányos vagy anaerob, vagy erjesztett vagy disszimilált. |
Az ebben a szakaszban, enzimek részvételével keletkező anyagok tovább bomlanak. Például: a glükóz két tejsavmolekulára és két ATP -molekulára bomlik. |
Az ATP és a H3PO4 részt vesz a glükóz hasítási reakcióiban. A glükóz oxigénmentes lebontása során az energia 40% -a kémiai kötés formájában tárolódik az ATP molekulában, a többi hő formájában oszlik el. Egy glükózmolekula lebomlásának minden esetben két ATP molekula keletkezik. |
|
|
Az aerob légzés vagy az oxigénbontás szakasza. |
Ha oxigén áll a sejt rendelkezésére, az előző szakaszban képződött anyagok oxidálódnak (bomlanak) a végtermékkéCO és HO. |
Az aerob légzés teljes egyenlete:
|
2.2.4. Erjesztés.
Fermentációs anyagcsere -az ATP képződése jellemzi a szubsztrátok foszforilezésével.
-
Először (oxidáció) = hasítás
-
Második (helyreállítás)
Tartalmazza a glükóz piruvinsavvá alakítását.
Tartalmazza a hidrogén visszanyerését a piruvinsav visszanyeréséhez.
A piruvinsav szénhidrátokból történő előállításának útjai
2.2.5. Piruvinsav.
Glikolitikus út (Embden-Meyerhof-Parnassus út)
Entner-Dudorov út
Pentóz -foszfát út
2.2.5. Táblázat Erjesztés.
|
№ |
Fermentációs típus |
Képviselők |
Végtermék |
Jegyzetek (szerkesztés) |
|
Tejsav |
|
Piruvátból tejsavat képez |
Bizonyos esetekben (homofermentációs erjedés) csak tejsav képződik, más esetekben melléktermékek is. |
|
|
Hangyasav |
|
A hangyasav az egyik végtermék. (vele együtt - oldalán) |
Néhány enterobacteriaceae lebontja a hangyasavat H2 -re és CO2 -re |
|
|
Vajsav |
|
Vajsav és melléktermékei |
A clostridia egyes típusai a vajsavval és más savakkal együtt butanolt, acetont stb. Képeznek (akkor aceton-butil fermentációnak nevezik). |
|
|
Propionsav |
|
Piruvátból propionsavat képez |
Sok baktérium más élelmiszerekkel együtt fermentálja a szénhidrátokat, etil -alkoholt képezve. Ez azonban nem fő termék. |
2.3.1. Táblázat Fehérjeszintézis rendszer, ioncsere.
|
№ |
Termék név |
Jellegzetes |
|
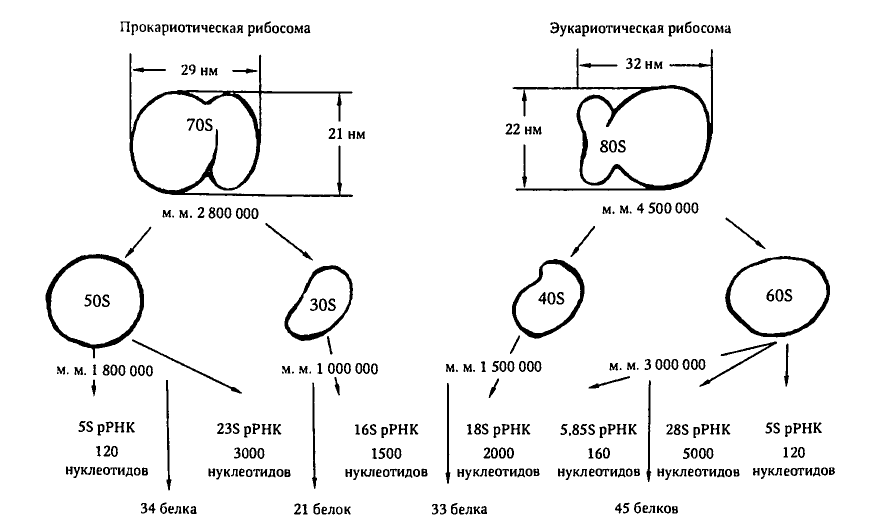
30S és 50S riboszomális alegységek |
A bakteriális 70S riboszómák esetében az 50S alegység 23S rRNS -t (~ 3000 nukleotid hosszú) és a 30S alegység 16S rRNS -t (~ 1500 nukleotid hosszúságú) tartalmaz; a nagy riboszómális alegység a „hosszú” rRNS mellett egy vagy két „rövid” rRNS -t is tartalmaz (az 50S vagy 5S bakteriális riboszómális alegységek 5S rRNS -e és az eukarióták nagy riboszómális alegységeinek 5.8S rRNS -e). (További részletekért lásd a 2.3.1. Ábrát.) |
|
|
Messenger RNS (mRNS) |
RNS, amely információkat tartalmaz a fehérjék elsődleges szerkezetéről (aminosav -szekvenciájáról) |
|
|
Húsz aminoacil-tRNS teljes készlete, amelyek előállításához a megfelelő aminosavak szükségesek, aminoacil-tRNS szintetázok, tRNS és ATP |
Ez egy aminosav, amely energiával van feltöltve és kötődik a tRNS -hez, készen áll a riboszómába történő szállításra, és beépül a rajta szintetizált polipeptidbe. |
|
|
Szállítási RNS (tRNS) |
Ribonukleinsav, amelynek feladata az aminosavak fehérjeszintézis helyére történő szállítása. |
|
|
Fehérje beindítási tényezők |
(prokariótákban-IF-1, IF-2, IF-3) Azért kapták a nevüket, mert részt vesznek egy 30S és 50S alegységekből álló aktív komplex (708-komplex), mRNS és iniciátor aminoacil-tRNS (in prokarióták - formilmetionil -tRNS), amely "elindítja" (kezdeményezi) a riboszómák munkáját - az mRNS fordítását. |
|
|
Fehérje megnyúlási tényezők |
(prokariótákban-EF-Tu, EF-Ts, EF-G) Vegyen részt a szintetizált polipeptidlánc (peptidil) megnyúlásában (megnyúlásában). A fehérje felszabadulási faktorok (RF) biztosítják a polipeptid kodon-specifikus elválasztását a riboszómától és a fehérjeszintézis befejezését. |
|
|
№ |
Termék név |
Jellegzetes |
|
Fehérje terminációs tényezők |
(prokariótákban-RF-1, RF-2, RF-3) |
|
|
Néhány más fehérjefaktor (asszociációk, alegységek disszociációja, felszabadulás stb.). |
A rendszer működéséhez szükséges fehérje transzlációs tényezők |
|
|
Guanozin -trifoszfát (GTP) |
A sugárzáshoz a GTF részvétele szükséges. A GTP fehérjeszintetizáló rendszerének igénye nagyon specifikus: nem helyettesíthető más trifoszfátokkal. A sejt több energiát költ a fehérjék bioszintézisére, mint bármely más biopolimer szintézisére. Minden új peptidkötés kialakulásához négy nagy energiájú kötést (ATP és GTP) kell lehasítani: kettőt a tRNS-molekula aminosavval való feltöltéséhez, további kettőt pedig a megnyúlás során-egyet az aa-tRNS-kötés során, a másikat transzlokáció során. |
|
|
Szervetlen kationok bizonyos koncentrációban. |
A rendszer pH -értékének élettani határokon belüli fenntartására. Egyes baktériumok ammóniumionokat használnak aminosavak szintézisére, káliumionokat használnak a tRNS riboszómákhoz való kötésére. A vas- és magnéziumionok számos enzimatikus folyamatban kofaktorként játszanak szerepet |
2.3.1. A prokarióta és eukarióta riboszómák szerkezetének sematikus ábrázolása.
Szerző - Korotyaev, 68. o. "Orvosi mikrobiológia"
2.3.2. Táblázat A baktériumok ioncseréjének jellemzői.
|
№ |
Sajátosság |
Azzal jellemezve: |
|
|
Magas ozmotikus nyomás |
A káliumionok jelentős sejten belüli koncentrációja miatt a baktériumok magas ozmotikus nyomást tartanak fenn. |
||
|
Vasbevitel |
Számos kórokozó és opportunista baktérium (Escherichia, Shigella stb.) Esetében a vasfogyasztás a gazdaszervezetben nehéz, mivel semleges és enyhén lúgos pH -értékeken oldhatatlan. |
Siderophores -speciális anyagok, amelyek a vas megkötésével oldhatóvá és szállíthatóvá teszik. |
|
|
Asszimiláció |
A baktériumok aktívan asszimilálják a SO2 / és PO34 + anionokat a környezetből az ezeket az elemeket tartalmazó vegyületek (kéntartalmú aminosavak, foszfolipidek stb.) Szintéziséhez. |
||
|
Jónás |
A baktériumok szaporodásához és szaporodásához ásványi vegyületekre van szükség - NH4 +, K +, Mg2 +, stb. (További részletekért lásd a 2.3.1. Táblázatot). |
||
Táblázat: 2.3.3. Ioncsere
|
№ |
Ásványi vegyületek neve |
Funkció |
|
NH4 + (ammónium -ionok) |
Egyes baktériumok aminosavak szintézisére használják |
|
|
K + (kálium -ionok) |
|
|
|
Fe2 + (vasionok) |
|
|
|
Mg2 + (magnézium -ionok) |
||
|
SO42- (szulfát-anion) |
Szükséges az ezeket az elemeket tartalmazó vegyületek (kéntartalmú aminosavak, foszfolipidek stb.) Szintéziséhez. |
|
|
PO43- (foszfát-anion) |
2.4.1. Energia anyagcsere.
A szintézishez a baktériumoknak ...
-
Tápanyagok
-
Energia
2.4.1. Táblázat Energia -anyagcsere (biológiai oxidáció).
|
№ |
Folyamat |
Szükséges: |
|
A mikrobiális sejtek szerkezeti összetevőinek szintézise és a létfontosságú folyamatok fenntartása |
Megfelelő mennyiségű energia. Ezt az igényt kielégíti a biológiai oxidáció, amelynek eredményeként ATP molekulák szintetizálódnak. |
|
|
Energia (ATP) |
A vasbaktériumok energiát kapnak a vas közvetlen oxidációja során (Fe2 + Fe3 +), amelyet a CO2 rögzítésére használnak, a kén metabolizáló baktériumok energiát biztosítanak maguknak a kéntartalmú vegyületek oxidációja miatt. A prokarióták túlnyomó része azonban dehidrogénezés útján nyer energiát. A légzés során energia is érkezik (a részletes táblázatot lásd a megfelelő részben). |
2.4. Biológiai oxidáció prokariótákban.
A polimerek bomlása monomerre
I. szakasz
Fehérje
Zsírok
Szénhidrátok
glicerin és zsírsavak
aminosavak
monoszacharidok
Bomlás anoxikus körülmények között
II. Szakasz
Közbenső termékek keletkezése
Oxidációs körülmények között végtermékké történő oxidáció
III. Szakasz
CO2
H2O
2.4.2. Táblázat Energia anyagcsere.
|
№ |
Koncepció |
Jellegzetes |
|
Az energia -anyagcsere lényege |
Az élet megnyilvánulásához szükséges sejtek energiájának biztosítása. |
|
|
ATF |
Az ATP molekula az elsődleges donorból a végső akceptorba történő elektron transzfer eredményeként szintetizálódik. |
|
|
Lehelet |
|
|
|
Energia mozgósítása |
Az energiát az oxidációs és redukciós reakciók mobilizálják. |
|
|
Oxidációs reakció |
Az anyag azon képessége, hogy elektronokat adjon (oxidáljon) |
|
|
Helyreállítási reakció |
Az anyag azon képessége, hogy elektronokat rögzítsen. |
|
|
Redoxpotenciál |
Az anyag azon képessége, hogy elektronokat adjon (oxidáljon) vagy fogadjon (nyerjen). (mennyiségi kifejezés) |
2.5. Szintézis.
SZINTÉZIS
fehérjék
zsír
szénhidrátok
2.5.1. Táblázat Szintézis
|
№ |
Név |
Jellegzetes |
|
Citoplazma |
A kezdeti termékek szintézise a citoplazmában történik. |
|
|
Citoplazmatikus membrán |
A citoplazmából származó kiindulási termékek a citoplazmatikus membrán külső felületére kerülnek. |
|
|
Morfogenezis |
A CPM -en a morfogenezis kezdődik, vagyis a sejtszerkezetek (kapszulák, sejtfalak stb.) Kialakulása enzimek részvételével. |
2.5.1. Táblázat Szintézis
|
№ |
Bioszintézis |
Miből |
Jegyzetek (szerkesztés) |
|
én |
A szénhidrátok bioszintézise |
Az autotrófok glükózt szintetizálnak CO2 -ból. A heterotrófok széntartalmú vegyületekből szintetizálják a glükózt. |
Calvin -ciklus (lásd a 2.2.1. Ábrát) |
|
II |
Aminosavak bioszintézise |
A legtöbb prokarióta képes az összes aminosavat szintetizálni:
|
Az energiaforrás az ATP. A piruvát a glikolitikus ciklusban képződik. Auxotróf mikroorganizmusok - készen fogyasztva a gazdaszervezetben. |
|
III |
Lipid bioszintézis |
A lipideket egyszerűbb vegyületekből - fehérjék és szénhidrátok metabolikus termékeiből - szintetizálják |
Az acetil-transzfer fehérjék fontos szerepet játszanak. Auxotróf mikroorganizmusok - készen fogyasztva a gazdaszervezetben vagy táptalajból. |
2.5.2. Táblázat A fehérje bioszintézisének fő szakaszai.
|
№ |
Szakasz |
Jellegzetes |
Jegyzetek (szerkesztés) |
|
Átirat |
Az RNS -szintézis folyamata géneken. Ez az információ átírásának folyamata DNS -génről mRNS -génre. |
A vizsgálatot DNS -függő RNS -polimeráz segítségével végezzük. A fehérje szerkezetére vonatkozó információ átadása a riboszómákhoz mRNS segítségével történik. |
|
|
Közvetítés (átvitel) |
A saját fehérje bioszintézisének folyamata. A genetikai kód dekódolásának folyamata az mRNS -ben és megvalósítása polipeptidlánc formájában. |
Mivel minden kodon három nukleotidot tartalmaz, ugyanaz a genetikai szöveg háromféleképpen olvasható (az első, második és harmadik nukleotidból kiindulva), azaz három különböző olvasási keretben. |
-
Megjegyzés a táblázathoz: Minden fehérje elsődleges szerkezete az aminosavak szekvenciája.
2.5.2. Elektronátviteli láncok a hidrogén elsődleges donorától (elektronoktól) a végső elfogadójáig O2.
Szerves anyag
(elsődleges elektrondonor)
NAD (- 0,32)
Flavoprotein (- 0,20)
Kinon (- 0, 07)
Citokróm (+0,01)
Citokróm C (+0,22)
Citokróm A (+0,34)
O2 (+0,81)
végső elfogadó
3.1. Táblázat Az élőlények osztályozása élelmiszerfajták szerint.
|
№ |
Organogén elem |
Ételfajták |
Jellegzetes |
|
Szén (C) |
|
Ők maguk szintetizálják a sejt összes széntartalmú összetevőjét a CO2-ból. |
|
|
CO2-val nem tudják kielégíteni igényeiket, kész szerves vegyületeket használnak. |
||
|
Az élelmiszerforrás elhalt szerves szubsztrátok. |
||
|
A táplálékforrás állatok és növények élő szövetei. |
||
|
Nitrogén (N) |
|
Kielégítse igényeiket légköri és ásványi nitrogénnel |
|
|
Kész szerves nitrogénvegyületekre van szükség. |
||
|
Hidrogén (H) |
A fő forrás a H2O |
||
|
Oxigén (O) |
|||
3.1.2. Táblázat Energia átalakítás
|
№ |
Osztályozás |
Név |
Kívánt: |
|
Energiaforrás szerint |
|
napfény |
|
|
Redox reakciók |
||
|
Elektron donor által |
|
Szervetlen vegyületek (H2, H2S, NH3, Fe stb.) |
|
|
Szerves vegyületek |
3.1.3. Táblázat Szén -etetési módszerek
|
№ |
Energiaforrás |
Elektron donor |
Szén -etetési módszer |
|
Napfény energiája |
Szervetlen vegyületek |
Fotolithoheterotrófok |
|
|
Szerves vegyületek |
Fotoorganoheterotrófok |
||
|
Redox reakciók |
Szervetlen vegyületek |
Kémolitheterotrófok |
|
|
Szerves vegyületek |
Kémiorganoheterotrófok |
3.2. Táblázat Teljesítménymechanizmusok:
|
№ |
Gépezet |
Körülmények |
Koncentrációs gradiens |
Energiaköltségek |
Aljzat sajátossága |
|
Passzív diffúzió |
A tápanyagok koncentrációja a közegben meghaladja a sejtben lévő koncentrációt. |
Koncentrációs gradiens szerint |
– |
– |
|
|
Könnyített diffúzió |
A permeáz fehérjék részt vesznek. |
Koncentrációs gradiens szerint |
– |
+ |
|
|
Aktiv szállitás |
A permeáz fehérjék részt vesznek. |
A koncentrációs gradiens ellen |
+ |
+ |
|
|
3A |
A kémiai csoportok transzlokációja |
Az átviteli folyamat során a tápanyagok kémiai módosulása következik be. |
A koncentrációs gradiens ellen |
+ |
+ |
3.3. Táblázat Tápanyagok szállítása a baktériumsejtből.
|
№ |
Név |
Jellegzetes |
|
Foszfotranszferáz reakció |
Az átvitt molekula foszforilezésénél fordul elő. |
|
|
Fordítási szekréció |
Ebben az esetben a szintetizált molekuláknak speciális vezető aminosav -szekvenciával kell rendelkezniük ahhoz, hogy a membránhoz kapcsolódjanak, és csatornát képezzenek, amelyen keresztül a fehérjemolekulák a környezetbe juthatnak. Így tetanusz, diftéria és más molekulák toxinjai szabadulnak fel a megfelelő baktériumok sejtjeiből. |
|
|
Membrán bimbózás |
A sejtben képződő molekulákat membránvezikulum veszi körül, amely leválik a környezetre. |
4. táblázat. Növekedés.
|
№ |
Koncepció |
A fogalom meghatározása. |
|
Magasság |
Az élő anyag mennyiségének visszafordíthatatlan növekedése, leggyakrabban a sejtosztódás miatt.Ha a többsejtű szervezetekben általában a testméret növekedése figyelhető meg, akkor a többsejtű szervezetekben a sejtek száma nő. De még a baktériumok esetében is meg kell különböztetni a sejtek számának növekedését és a sejttömeg növekedését. |
|
|
A baktériumok in vitro növekedését befolyásoló tényezők. |
A Mycobacterium leprae in vitro nem képes Chlamydia növekedés (beleértve a parazitákat is)
|
|
|
A baktériumok szaporodásának értékelése |
A növekedés számszerűsítését általában folyékony táptalajban végzik, ahol a növekvő baktériumok homogén szuszpenziót képeznek. A sejtek számának növekedését úgy határozzuk meg, hogy meghatározzuk a baktériumok koncentrációját 1 ml -ben, vagy a sejttömeg növekedését tömegegységekben határozzuk meg. |
Növekedési tényezők
Lipidek
Aminosavak
Vitaminok
Nitrogén bázisok
4.1. Táblázat Növekedési tényezők
|
№ |
Növekedési tényezők |
Jellegzetes |
Funkció |
|
|
Aminosavak |
|
Sok mikroorganizmusnak, különösen a baktériumoknak szüksége van egy vagy több aminosavra (egy vagy több), mivel nem tudják önmaguk szintetizálni. Az ilyen típusú mikroorganizmusokat auxotrófnak nevezik azoknál az aminosavaknál vagy más vegyületeknél, amelyeket nem képesek szintetizálni. |
||
|
Purin bázisok és származékaik |
Nukleotidok:
|
Ezek a baktériumok növekedési tényezői. A mikoplazmák bizonyos típusai nukleotidokat igényelnek. Szükséges a nukleinsavak építéséhez. |
||
|
Pirimidin bázisok és származékaik |
Nukleotidok
|
|||
|
№ |
Növekedési tényezők |
Jellegzetes |
Funkció |
|
|
Lipidek |
|
A membrán lipidek egy része |
||
|
||||
|
A foszfolipidek összetevői |
|||
|
A mikoplazmákban a citoplazmatikus membrán részét képezik |
|||
|
||||
|
Vitaminok (főleg B csoport) |
|
Staphylococcus aureus, pneumococcus, Brucella |
||
|
Mindenféle rúd alakú baktérium |
|||
|
Bifidobaktériumok és propionsav |
|||
|
A streptococcusok bizonyos típusai, a tetanusz bacilusok |
|||
|
Élesztő- és nitrogénmegkötő baktériumok Rhizobium |
|||
|
Hemes - a citokróm összetevői |
Hemofil baktériumok, mycobacterium tuberculosis |
|||
5. táblázat: Légzés.
|
№ |
Név |
Jellegzetes |
|
Lehelet |
Biológiai oxidáció (enzimatikus reakciók) |
|
|
Bázis |
A légzés redoxreakciókon alapul, amelyek az ATP, a kémiai energia univerzális akkumulátora kialakulásához vezetnek. |
|
|
Folyamatok |
Légzéskor a következő folyamatok mennek végbe:
|
|
|
Aerob légzés |
A hidrogén vagy elektronok végső elfogadója a molekuláris oxigén. |
|
|
Anaerob légzés |
A hidrogén vagy elektronok akceptorja egy szervetlen vegyület-NO3-, SO42-, SO32-. |
|
|
Erjesztés |
A szerves vegyületek elfogadják a hidrogént vagy az elektronokat. |
5.1. Táblázat A légzés osztályozása.
|
№ |
Baktériumok |
Jellegzetes |
Jegyzetek (szerkesztés) |
|
Szigorú anaerobok |
|
|
|
|
Szigorú aerob |
|
A szigorú aerobok közé tartoznak például a Pseudomonas nemzetség képviselői |
|
|
№ |
Baktériumok |
Jellegzetes |
Jegyzetek (szerkesztés) |
|
Fakultatív anaerobok |
|
A fakultatív anaerobok közé tartoznak az enterobaktériumok és sok olyan élesztőgomba, amelyek O2 jelenlétében lélegeztetésről O2 hiányában fermentációra válthatnak. |
|
|
Mikroaerofilek |
Olyan mikroorganizmus, amely a szigorú anaerobokkal ellentétben oxigén jelenlétét igényli a légkörben vagy a táptalajban a növekedéséhez, de csökkentett koncentrációban a normál levegőben vagy a gazdaszervezet normál szöveteiben lévő oxigéntartalomhoz képest (ellentétben az aerobokkal) , amelynek növekedéséhez normális oxigéntartalom a légkörben vagy a tápközegben). Sok mikroaerofil is kapnofil, vagyis fokozott szén -dioxid koncentrációt igényel. |
A laboratóriumban az ilyen organizmusokat könnyen "gyertyatartóban" termesztik. A "gyertyaüveg" egy tartály, amelybe égő gyertyát vezetnek be, mielőtt légmentesen lezárják. A gyertya lángja addig ég, amíg ki nem oltja az oxigénhiányból, aminek következtében a kannában csökkentett oxigéntartalmú szén -dioxiddal telített légkör keletkezik. |
6. táblázat: A szaporodás jellemzői.
|
№ |
Név |
Jellegzetes |
|
Reprodukció |
A "szaporítás" kifejezés a populációban a sejtek számának növekedését jelenti. A legtöbb prokarióta keresztirányú osztódással szaporodik, néhány pedig bimbózással. A gombák sporulációval szaporodnak. |
|
|
Merre tart |
Amikor egy mikrobiális sejt szaporodik, a legfontosabb folyamatok a sejtmagban (nukleoid) játszódnak le, amely minden genetikai információt tartalmaz egy kétszálú DNS-molekulában. |
Séma 6. A generáció időtartamának függése különböző tényezőktől.
Generáció időtartama
A baktériumok típusa
Kor
Népesség
Hőfok
A táptalaj összetétele
6.1. Táblázat A baktériumok szaporodásának fázisai.
|
№ |
Fázis |
Jellegzetes |
|
én |
Kezdeti állófázis |
1-2 órát tart. Ebben a fázisban a baktériumsejtek száma nem nő. |
|
II |
Késleltetési fázis (késleltetett tenyésztési szakasz) |
Az intenzív sejtnövekedés kezdete jellemzi, de a sejtosztódás sebessége alacsony marad. |
|
III |
Naplózási fázis (logaritmikus) |
Különbözik a sejtek szaporodásának maximális arányában és a baktériumpopuláció számának exponenciális növekedésében |
|
IV |
Negatív gyorsulási fázis |
Jellemzője a baktériumsejtek alacsonyabb aktivitása és a generációs időszak meghosszabbodása. Ez a tápközeg kimerülése, az anyagcsere -termékek felhalmozódása és az oxigénhiány következtében következik be. |
|
V |
Stacionárius fázis |
Jellemzője az egyensúly az elhalt, újonnan képződött és alvó sejtek száma között. |
|
VI |
A végzet fázisa |
Állandó ütemben fordul elő, és UP-USH fázisok váltják fel, amelyek csökkentik a sejtpusztulás mértékét. |
Séma 7. A táptalajra vonatkozó követelmények.
Követelmények
Viszkozitás
páratartalom
Sterilitás
Tápérték
Átláthatóság
Izotóniás
a környezet pH -ja
7. táblázat. Baktériumok szaporodása táptalajokon.
|
№ |
Tápközeg |
Jellegzetes |
|
|
Sűrű táptalaj |
A sűrű táptalajokon a baktériumok kolóniákat képeznek - sejtcsoportokat. |
||
|
S - típusú (sima - sima és fényes) Kerek, egyenletes szélű, sima, domború. |
R - típusú (durva - durva, egyenetlen) Szabálytalan alakú, szaggatott élekkel, érdes, horpadt. |
||
|
Folyékony tenyésztőközeg |
|
||
7.1. Táblázat A táptalajok osztályozása.
|
№ |
Osztályozás |
Nézetek |
Példák |
|
Összetétel szerint |
Egyszerű |
|
|
|
Összetett |
|
||
|
Bejelentkezés alapján |
A fő |
|
|
|
Választható |
|
||
|
Differenciál - diagnosztika |
|
||
|
Különleges |
|
||
|
A következetesség alapján |
Sűrű |
|
|
|
Folyékony |
|
||
|
Félig folyékony |
|
||
|
Eredet szerint |
Természetes |
|
|
|
Félszintetikus |
|
||
|
Szintetikus |
|
Táblázat: 7.2. A tiszta sejttenyészet izolálásának elvei.
|
Mechanikai elv |
Biológiai elv |
|
MÓD 1. L. Pasteur frakcionált hígításai 2. Tányérhígítások R. Koch 3. Felszíni növények Drigalsky 4. Felületi ütések |
MÓD Fontolgat: a - a légzés típusa (Fortner módszer); b - mobilitás (Shukevich módszer); c - savállóság; d - sporuláció; d - optimális hőmérséklet; e - a laboratóriumi állatok szelektív érzékenysége a baktériumokra |
Táblázat: 7.2.1. A tiszta sejttenyészet izolálásának szakaszai.
|
№ |
Színpad |
Jellegzetes |
|
1. fázisú kutatás |
Vigye el a kóros anyagot. Tanulmányozzák - megjelenés, konzisztencia, szín, illat és egyéb jelek, kenetet készítenek, festenek és mikroszkóp alatt vizsgálnak. |
|
|
2. szakasz kutatása |
A sűrű tápközeg felszínén a mikroorganizmusok folyamatos, sűrű növekedést vagy elszigetelt telepeket képeznek.A gyarmat - Ezek a szabad szemmel látható baktériumok felhalmozódása a felszínen vagy a tápközeg vastagságában. Általában minden kolónia egy mikrobiális sejt leszármazottaiból (klónok) képződik, ezért összetételük meglehetősen homogén. A baktériumok táptalajokon való növekedésének jellemzői kulturális tulajdonságaik megnyilvánulása. |
|
|
3. fázisú kutatás |
Tanulmányozzák a mikroorganizmusok tiszta tenyészetének növekedésének jellegét és azonosítják. |
Táblázat: 7.3. A baktériumok azonosítása.
|
№ |
Név |
Jellegzetes |
|
Biokémiai azonosítás |
A kórokozó típusának meghatározása biokémiai tulajdonságai alapján |
|
|
Szerológiai azonosítás |
A baktériumfajok megállapítása érdekében gyakran tanulmányozzák azok antigén szerkezetét, vagyis antigén tulajdonságok alapján azonosítják őket. |
|
|
Azonosítás biológiai tulajdonságok alapján |
Néha a baktériumokat úgy azonosítják, hogy a laboratóriumi állatokat tiszta kultúrával fertőzik meg, és megfigyelik a kórokozók által a szervezetben okozott változásokat. |
|
|
Kulturális azonosulás |
A kórokozók típusának meghatározása kulturális jellemzőik alapján |
|
|
Morfológiai azonosítás |
A baktériumok típusának meghatározása morfológiai jellemzőik alapján |
Minősítés -ellenőrző tesztek
-
Melyik folyamat nem kapcsolódik a baktériumok fiziológiájához?
-
Magasság
-
Reprodukció
-
Mutáció
-
Táplálás
-
Milyen anyagok teszik ki a baktériumsejtek száraz tömegének 40-80% -át?
-
Szénhidrátok
-
Fehérje
-
Zsírok
-
Nukleinsavak
-
Milyen osztályú enzimeket szintetizálnak a mikroorganizmusok?
-
Oxi -reduktáz
-
Minden osztály
-
Transzferázok
-
Ligázok
-
Enzimek, amelyek koncentrációja a sejtben élesen megnő, válaszul az indukáló szubsztrát megjelenésére a közegben?
-
Iiducible
-
Alkotmányos
-
Elnyomó
-
Multienzim komplexek
-
A Staphylococcus aureus által kiválasztott patogenitási enzim?
-
Neuraminidáz
-
Hialuronidáz
-
Lecitináz
-
Fibrinolizin
-
A proteolitikus enzimek ellátnak valamilyen funkciót?
-
Fehérjék lebomlása
-
A zsírok lebontása
-
A szénhidrátok lebontása
-
Lúgképződés
-
Az Enterobacteriaceae erjesztése?
-
Tejsav
-
Hangyasav
-
Propionsav
-
Vajsav
-
Milyen ásványi vegyületeket használnak a t-RNS riboszómákhoz való kötésére?
-
NH4
-
K +
-
Fe2 +
-
Mg2 +
-
A biológiai oxidáció ...?
-
Táplálás
-
Reprodukció
-
Lehelet
-
Sejthalál
-
Milyen anyagok szintetizálják a sejt összes széntartalmú összetevőjét CO2-ból.
-
Prototrófok
-
Heterotrófok
-
Autotrófok
-
Szaprofiták
-
A kultúrák különbözőek:
-
Összetétel szerint
-
A következetesség alapján
-
Bejelentkezés alapján
-
A fentiek mindegyike
-
A szaporodási fázis, amelyet az elhalt, újonnan képződött és nyugalmi sejtek száma közötti egyensúly jellemez?
-
Késleltetési fázis
-
Naplózási fázis
-
Negatív gyorsulási fázis
-
Stacionárius fázis
-
A generáció időtartama függ?
-
Faj
-
Kor
-
Népességek
-
A fentiek mindegyike
-
A baktériumfajok megállapítása érdekében gyakran tanulmányozzák azok antigén szerkezetét, azaz azonosítást végeznek, melyiket?
-
Biológiai
-
Morfológiai
-
Szerológiai
-
Biokémiai
-
Drygalski felszíni vetési módszerét ...?
-
A tiszta kultúra izolálásának mechanikai elvei
-
A tiszta kultúra izolálásának biológiai elvei
Bibliográfia
1. Borisov LB Orvosi mikrobiológia, virológia, immunológia: mézes tankönyv. egyetemeken. - M.: LLC "Orvosi Információs Ügynökség", 2005.
2. Pozdeev OK Orvosi mikrobiológia: tankönyv a mézhez. egyetemeken. - M.: GEOTAR-MED, 2005.
3. Korotyaev AI, Babichev SA Orvosi mikrobiológia, immunológia és virológia / mézes tankönyv. egyetemeken. - SPb.: SpetsLit, 2000.
4. Vorobiev A.A., Bykov A.S., Pashkov E.P., Rybakova A.M. Microbiology: tankönyv. - M.: Orvostudomány, 2003.
5. Orvosi mikrobiológia, virológia és immunológia: tankönyv / szerk. V. V. Zvereva, M. N. Boychenko. - M.: GEOTar-Media, 2014.
6. Útmutató az orvosi mikrobiológia, virológia és immunológia gyakorlati képzéséhez / szerk. V. V. Teza. - M.: Orvostudomány, 2002.
Tartalom
Bevezetés 6
A baktériumok összetétele fiziológiájuk szempontjából. 7
Metabolizmus 14
Táplálkozás (tápanyagok szállítása) 25
Magasság 29
Lélegzet 31
Tenyésztés 34
Mikrobiális közösségek 37
MELLÉKLETEK 49
Tesztek 102
Hivatkozások 105
…………..
…………
Egyes emberi betegségek a szervezetben lévő mikrobáknak való kitettséghez kapcsolódnak. Amikor ilyen betegségek fordulnak elő az emberi szervezetben, komplex változások következnek be, védőfunkciókat mozgósítanak, amelyek célja a csapdába esett mikrobák elleni küzdelem.
A hatalmas számú mikroorganizmus között vannak olyanok, amelyek képesek betegségeket okozni emberekben, állatokban és növényekben. Ezeket kórokozónak vagy betegség okozónak nevezik. A specificitás a patogén mikroorganizmusokra jellemző - mindegyik típusuk csak egy bizonyos betegséget képes kiváltani, annak minden jellegzetes jeleivel. A legtöbb patogén mikroorganizmus parazita, mivel képes élni egy élő szervezet anyagából.
A kórokozó mikrobák speciális anyagokat termelnek - toxinokat, amelyek mérgezik a testet és fájdalmas állapotot okoznak. A mikroorganizmusok betegségkeltő képességét patogenitásnak nevezik. Különböző mértékben nyilvánulhat meg. A patogenitás mértékét virulenciának nevezzük.A mikrobák virulenciája növekedhet vagy csökkenhet mind természetes, mind kísérleti körülmények között.
Kifejezés alatt "fertőzés»Ismerje meg a mikrobák és az emberi test közötti kölcsönhatás folyamatát, amelynek következtében fertőző betegség lép fel. A fertőzés forrása mindenekelőtt a beteg emberek és állatok, amelyek kórokozókat bocsátanak ki a külső környezetbe, valamint azok a betegek és állatok, akiknek szervezetében a patogén mikrobák a gyógyulás után még egy ideig (néha nagyon sokáig) maradnak. . Azokat az embereket és állatokat, amelyek a gyógyulás után kórokozó mikrobákat bocsátanak ki, baktériumhordozónak vagy baktériumkiválasztónak nevezzük. A nem betegek is baktériumhordozók lehetnek. A beteg szervezet által izolált kórokozó mikrobák a levegőbe, a talajba, a vízbe, a környező tárgyakba és az élelmiszerekbe kerülnek, ahol a mikrobák típusától függően többé -kevésbé hosszú ideig életképesek maradhatnak.
A kórokozó mikrobák különböző módon jutnak be az emberi szervezetbe: beteg emberrel való közvetlen érintkezés útján, a levegőn keresztül a legkisebb nyálcseppekkel és nyállal, amelyeket köhögés vagy tüsszentés során a beteg kiválaszt (cseppfertőzés). A mikrobákat - egyes betegségek kórokozóit - a széklettel és a vizeletben szenvedő betegek választják ki. Az ilyen mikrobák piszkos kézzel jutnak be egy egészséges ember testébe, amelyet nem mostak meg a vécé használata után. A szennyezett kezek kórokozókat is terjesztenek az élelmiszerekre. A bélfertőzések kórokozói is behatolnak az egészséges szervezetbe, ha szennyezett vizet fogyasztanak.
A rovarok és rágcsálók gyakran fertőző betegségek hordozói. A legyek hordozhatják a tífusz -láz és a vérhas, a tetvek - a tífusz, egyes szúnyogok - a malária stb.
A kórokozó mikrobák behatolása az emberi testbe nem mindig vezet a betegségéhez. A betegség kezdetén és lefolyásában fontos szerepet játszanak a szervezetbe behatolt kórokozó mikrobák tulajdonságai, számuk és aktivitásuk, valamint a szervezetbe való bejutásuk helye és maga a test állapota.
A patogén mikroorganizmusok szaporodásához kedvező feltételekre van szükség, amelyek akkor jelennek meg, amikor az emberi test legyengül és védő képessége csökken (hipotermia, éhezés stb. Miatt). A fertőzésekre való fogékonyság az életkortól is függ (gyermekeknél és időseknél magasabb, mint felnőtteknél).
Attól a pillanattól kezdve, hogy a kórokozó mikrobák belépnek az emberi testbe, amíg a betegség jelei megjelennek, általában eltelik egy bizonyos idő - ezt a betegség látens időszakának vagy inkubációnak nevezik. Ez idő alatt a patogén mikrobák szaporodnak a szervezetben, és felhalmozódnak létfontosságú tevékenységük káros termékei. A különböző betegségek lappangási időtartama nem azonos. Ez több naptól (influenza, tetanusz, vérhas) több hétig (tífusz, tífusz) terjed, és néha több hónapot (veszettség), sőt éveket (lepra) is elér.
Ha hibát talál, jelöljön ki egy szövegrészt, és nyomja meg a Ctrl + Enter billentyűkombinációt.
Kulturális média - olyan alkotórészekből álló szubsztrátok, amelyek biztosítják a mikroorganizmusok szaporodásához vagy hulladékaik felhalmozódásához szükséges feltételeket
.
Kulturális média céljukban, összetételükben és összetételükben különböznek egymástól. Céljuk szerint hagyományosan két fő csoportra osztják őket - diagnosztikai és termelési környezetekre. A diagnosztikai táptalaj öt alcsoportot foglal magában: táptalaj a mikroorganizmusok széles körének termesztésére; táptalaj egy specifikus kórokozó elkülönítésére; differenciált közegek, amelyek lehetővé teszik bizonyos típusú mikroorganizmusok megkülönböztetését; a mikroorganizmusok azonosítására szolgáló táptalajok és a meghatározott típusú mikroorganizmusok gazdagítására szolgáló tárolóközeg. A termelés tartalmazza P. -vel. biológiai gyógyszerek (bakteriális vakcinák, toxoidok stb.) ipari előállításához és minőség -ellenőrzéséhez használják.A baktériumkészítmények előállításához használt tenyésztőközeg, a diagnosztikai táptalajjal ellentétben, nem tartalmazhat emberre káros szennyeződéseket, és negatív hatással lehet a termelési folyamatra (anélkül, hogy ne zavarná a mikrobiális anyagcsere termékeinek, szerves ballasztjának és ásványi anyagok az elkészített készítményekből).
A konzisztencia alapján megkülönböztetik a folyékony, sűrű és félig folyékony közegeket. A szilárd és félig folyékony tápközegeket folyékony közegekből állítják elő, agar vagy (ritkábban) zselatin hozzáadásával. Az agar agar egy poliszacharid, amely bizonyos moszatfajtákból származik. Az agart általában P. -vel vezetik be. 1-2%koncentrációban (félig folyékony közegek gyártásakor-0,2-0,4%), zselatin-10-15%. T ° 25-30 ° C-on a kocsonyás közeg olvad, ezért mikroorganizmusokat termesztenek rajtuk főleg szobahőmérsékleten. Szilárd közegként alvadt vérszérumot, tojásfehérjét, burgonyát és 1,5% szilikagélt tartalmazó tápközeget is használnak.
Összetételét tekintve a táptalaj egyszerű és összetett. Egyszerű P. -vel. biztosítja a legtöbb kórokozó mikroorganizmus táplálkozási szükségleteit (mezopátámiai húsleves, mezopátámia agar, Hottinger húsleves és agar, tápláló zselatin, peptonvíz stb.). A komplex táptalajok speciális táptalajokat tartalmaznak a mikrobák számára, amelyek nem egyszerű táptalajokon nőnek. Az ilyen közegeket úgy készítik el, hogy vért, szérumot, szénhidrátot és egyéb anyagokat adnak hozzá egy adott mikroorganizmus reprodukciójához egyszerű táptalajokhoz. Komplex P. -vel. Vannak differenciáldiagnosztikai közegek is, például a Giss tápközeg szénhidrátot és egy indikátort használnak a vizsgált mikroba fajtájának meghatározására enzimatikus aktivitása alapján. Néhány összetett táptalaj, az úgynevezett szelektív vagy választható, egy vagy többféle mikroorganizmus célzott izolálására szolgál, optimális feltételeket teremtve növekedésükhöz és a kísérő mikroflóra növekedésének gátlásához. Például a bizmut -szulfit agar szigorúan szelektív közeg a Salmonella izolálásához, az agar és a Levin táptalaj gyengén szelektív táptalaj az enterobaktériumok izolálására.
A kezdeti komponensek összetételétől függően szintetikus, félszintetikus és természetes közegeket is megkülönböztetnek. A szintetikus közegek, amelyek összetevői pontosan ismertek, és valamivel kisebb mértékben félszintetikusak, kényelmesek, és főleg a mikroorganizmusok élettani folyamatainak vizsgálatára szolgálnak. Az ilyen típusú közegek használata lehetővé teszi az egyes mikroorganizmusok tápanyagokkal szemben támasztott minimális követelményeinek meghatározását, és ennek alapján olyan tápközeg létrehozását, amely csak azokat a vegyületeket tartalmazza, amelyek szükségesek az adott mikrobák növekedéséhez. A szintetikus táptalaj előnye a szabványosításuk, azonban ezeknek a táptalajoknak a felhasználása korlátozott, mivel sokuk magas költsége és összetettsége miatt fordul elő (gyakran 40 vagy több összetevőt tartalmaznak). Ezenkívül érzékenyebbek a P. egyes összetevői közötti egyensúlyhiányra. , különösen az aminosavak, és a mikroorganizmusok szaporodását ilyen táptalajokon könnyebben elnyomják a túlzott levegőztetés vagy a mérgező kationok.
A mikrobiológiai gyakorlatban továbbra is széles körben használják a természetes eredetű közegeket, amelyek kémiai összetétele nem ismert. Az ilyen közegek alapját különféle állati vagy növényi eredetű nyersanyagok alkotják: hús és helyettesítői, hal, állati vér, kazein, élesztő, burgonya, szójabab, stb.
A fehérjebázisok mellett a táptalajoknak hamutartalmú elemeket (foszfor, kén, kalcium, magnézium, vas) és nyomelemeket (bór, molibdén, kobalt, mangán, cink, nikkel, réz, klór, nátrium, szilícium stb.) Kell tartalmazniuk. Ezek az anyagok a baktériumok számos bioszintetikus folyamatához szükségesek, de szükségük nincs rájuk a különböző típusú mikroorganizmusokban. Például mangán és vas szükséges az E. coli és a pestis kórokozóihoz, kálium pedig a tejsavbaktériumokhoz. A mangán, a kalcium, a magnézium, a kálium és a vas serkenti a lépfene bacillus növekedését, a magnézium, a vas és a mangán pedig a brucella növekedését.
Sok kórokozó mikroorganizmus tenyésztéséhez szükség van az úgynevezett növekedési faktorok jelenlétére a tápközegben, amelyeket elsősorban vízben oldódó vitaminok képviselnek. Bár a baktériumok nem használják ezeket az anyagokat műanyagként vagy energetikai anyagként, mindazonáltal nélkülözhetetlen összetevői a táptalajoknak, mivel hiányuk sok enzim képződését gátolja. Bizonyos szerves savak, purin és pirimidin bázisok és aminosavak szintén növekedési faktorok lehetnek. Bizonyos aminosavak (L-cisztin, D-piroglutaminsav stb.) Képesek stimulálni egyes mikroorganizmusok növekedését, és fordítva, gátolni mások növekedését.
Kulturális média könnyen asszimilálható formában és optimális mennyiségben kell tartalmaznia a termesztett mikroorganizmusokhoz szükséges összes kémiai elemet. A szénforrás a P. s. általában vannak egyedi szénhidrátok, szerves savak sói, valamint szén, amely része a nitrogéntartalmú vegyületeknek (fehérjék, peptonok, aminosavak stb.). A nitrogénszükséglet akkor teljesül, ha a közegben (vér, szérum, aszcitikus folyadék stb.) Natív állati fehérje, peptonok, aminosavak, ammóniumsók és más nitrogéntartalmú anyagok (purin- és pirimidinbázisok, karbamid stb.) Találhatók. . V tápközeg készítsen ásványi sókat a mikroorganizmusok számára. A baktériumok által elhanyagolható mennyiségben szükséges mikroelemek általában vagy a táptalaj előállításához használt vízzel vagy a tápközeg részét képező nyersanyagokkal kerülnek a tápközegbe. A növekedési faktorok különböző dializátumokkal, kivonatokkal és autolizátumokkal lépnek be a környezetbe aminosavak, peptidek, purin és pirimidin bázisok és vitaminok formájában.
A tápközeg előállításához használt fehérjetartalmú nyersanyagokat különböző enzimek (pepszin, tripszin, pankreatin, papain, gombás proteázok stb.) Vagy savak (ritkábban lúgok) alkalmazásával hidrolizálják. A hidrolízis célja a fehérje feloldása és lebontása a mikrobiális sejt által asszimilált nitrogénvegyületek képződésével: peptonok, polipeptidek, aminosavak, amelyek az így kapott hidrolizátumok részét képezik. Az egyes mikroorganizmus -típusok táplálkozási igényeinek kielégítésére ezeket vagy azokat a hidrolizátumokat használják, kémiai összetételüktől függően, vagy a P. összetételével. a használt arányokban egyszerre több hidrolizátumot vezetnek be.
P. -vel tervezve. összetételében és fizikai -kémiai tulajdonságaiban meg kell felelnie a mikroorganizmusok természetes élőhelyének feltételeinek. Táplálkozási szükségleteikben olyan sokfélék a különbségek, hogy kizárják az univerzális P. létrehozásának lehetőségét. Ezért a médiatervezés modern elvei a mikroorganizmusok táplálkozási igényeinek átfogó vizsgálatán alapulnak.
Szükséges, hogy a táptalajok ne csak a mikrobákhoz szükséges tápanyagokat tartalmazzák, hanem optimális hidrogén- és hidroxil -ion koncentrációt is. A legtöbb patogén mikroorganizmus jobban nő a táptalajokon enyhén lúgos reakcióval (pH 7,2-7,4).Kivételt képeznek a Vibrio cholerae, amelynek optimális növekedése a lúgos zónában van (pH 8,5-9,0), valamint a gyengén savas reakciót igénylő tuberkulózis kórokozója (pH 6,2-6,8). Hogy megakadályozzuk a pH változását a mikroorganizmusok tenyésztése során a P. -vel. adjunk hozzá foszfátpuffereket - mono- és diszubsztituált kálium -foszfátok keverékét, amelynek koncentrációja a közegben nem haladhatja meg a 0,5%-ot.
Kulturális média elegendő páratartalmúnak kell lennie, és izotóniásnak kell lennie a mikrobiális sejt számára, ami biztosítja a legfontosabb fizikai és kémiai folyamatok normális lefolyását. A legtöbb mikroorganizmus számára az optimális környezet a 0,5% -os nátrium -klorid -oldat. A táptalajok egyik alapvető követelménye a sterilitásuk, amely lehetővé teszi a tiszta mikrobák tenyésztését.
Fontos szerepe P. oldalankénti átvételében. ellenőrzésük módszerei közé tartozik a megfelelő minőség. A termelésben használt táptalajok esetében a fő minőségi mutató a közeg hatékonysága (hozam), azaz az a képesség, hogy felhalmozza a maximális mennyiségű biomasszát a teljes tulajdonságú mikroorganizmusokból vagy bioszintézisük termékeiből (toxinok stb.). A diagnosztikus táptalajok értékelésekor a vezető kritérium az érzékenységi mutató - az a képesség, hogy biztosítsák a mikroorganizmusok növekedését a kórokozó tenyészet maximális hígításaiban. A táptalajok rendeltetésétől függően minőségük értékelésénél más mutatókat is alkalmaznak - a termesztett mikroorganizmusok fő tulajdonságainak stabilitását és növekedési ütemüket, a differenciáló tulajdonságok súlyosságát stb.
A táptalajok minőségi kérdéseinek megoldása során fontos fontosságú a szabványosításuk, amelyet elősegít a száraz készítmények formájában előállított közeg. A Szovjetunióban létrehozták a különböző célú száraz médiumok ipari termelését: egyszerű, szelektív, differenciáldiagnosztikai és speciális.
Bibliográfia: Kozlov Yu.A. Kulturális média az orvosi mikrobiológiában, M., 1950, bibliogr.; Laboratóriumi kutatási módszerek a klinikán, szerk. V.V. Menszikov, s. 315, 343, M., 1987; Meinell J. és Meinell E. Experimental Microbiology, ford. angolból, p. 46, M., 1967; Fertőző betegségek mikrobiológiai kutatási módszerei, szerk. G.Ya. Sinai és O.G. Birger, s. 64, M., 1949; Enterobacteriaceae, szerk. IN ÉS. Pokrovsky, p. 258, M., 1985.
Figyelem! Cikk 'Kulturális média„Csak tájékoztató jellegű, és nem szabad öngyógyításra használni